HLA基因泛癌分析发6分+SCI
大家好!今天给大家介绍一篇2022年8月发表在Molecular cancer research(IF:6.333)上的一篇文章。作者在泛癌水平上分析HLA基因的表达水平及其在免疫微环境中的作用。
Pan-cancer HLA Gene-mediated Tumor Immunogenicity and Immune Evasion
泛癌中HLA基因介导的肿瘤免疫原性和免疫逃避
摘要
人白细胞抗原(HLA)表达通过与T细胞受体互作激活抗肿瘤免疫。泛癌HLA介导的免疫原性和免疫编辑机制尚未系统研究。本研究分析了TCGA泛癌数据集中HLA I类和II类基因在各种致癌通路和免疫亚型中的差异表达。HLA I基因在免疫原性“hot”肿瘤中上调表达,而HLA II基因在炎症免疫亚型中上调表达且预后较好,在特定的致癌通路中下调表达。此外,免疫原性“hot”肿瘤的一个亚型中HLA I基因上调表达而HLA II基因没有上调表达。作者使用机器学习模型证明使用HLA基因表达水平可以用来预测接受免疫治疗患者的免疫亚型并对患者进行生存分层。
流程图
结果
1. 数据集的获取和下载
从TCGA数据库下载33种癌症类型的基因表达数据集,甲基化数据和全外显子数据集。
2. TCGA数据集中HLA基因的表达水平
首先,作者评估了来自13个组织的31种TCGA癌症数据集中HLA I类,HLA II类基因和B2M的表达水平。B2M和大多数HLA I类基因的表达水平高于HLA II类基因(图1A),HLA-G和HLA-DO分别为I类和II类基因中表达水平最低的基因。HLA基因表达水平与免疫相关肿瘤特征的相关性分析表明,HLA I类和HLA II类基因的表达水平与抗肿瘤免疫细胞浸润水平相关性较强,包括M1巨噬细胞,CD 8 细胞毒性T细胞,激活CD4记忆T细胞,自然杀伤细胞,调节性T细胞和T辅助细胞1。HLA I类和HLA II类基因的表达水平与M2巨噬细胞,T辅助细胞2没有相关性(图1B)。HLA I类和HLA II类基因的表达水平与免疫原性正相关,HLA II类基因表达水平较高的患者生存率较高。对接受ICB治疗的黑色素瘤患者的数据集分析表明,接受治疗前HLA II表达水平可以预测患者生存情况,TMB,PDCD1表达水平和CYT(图1C)。随后,作者评估了不同MSI状态下COAD,STAD和UCEC患者中HLA的表达水平,HLA II类基因在MSI-H亚型的COAD和STAD患者中表达水平较高。HLA I类基因表达水平较低的MSI-H患者与PFS显著相关(图1D)。HLA II类基因高表达的MSI-H患者的PFS较高(图1E)。以上结果表明,HLA I类和HLA II类基因的高表达有助于不同类型的免疫细胞的浸润,从而对MSI-H肿瘤的生存情况产生相反的影响。

图1 HLA-I和HLA-II类在癌症中的表达水平
3. HLA高表达肿瘤中HLA等位基因对阳性与生存情况提高的相关性
接下来,作者分析了HLA I类亚型在TCGA肿瘤中的分布。总的来说,各个亚型在各个癌症类型中分布没有差异(图2A)。此外,作者使用HLA-I进化分化(HED)打分评估患者HLA I类等位基因的多样性。所有患者的HED中位数为6.66,范围在0-11.54之间(图2B)。Cox分析表明,HLA I类表达水平和HED打分较高与生存率显著相关(图2C)。
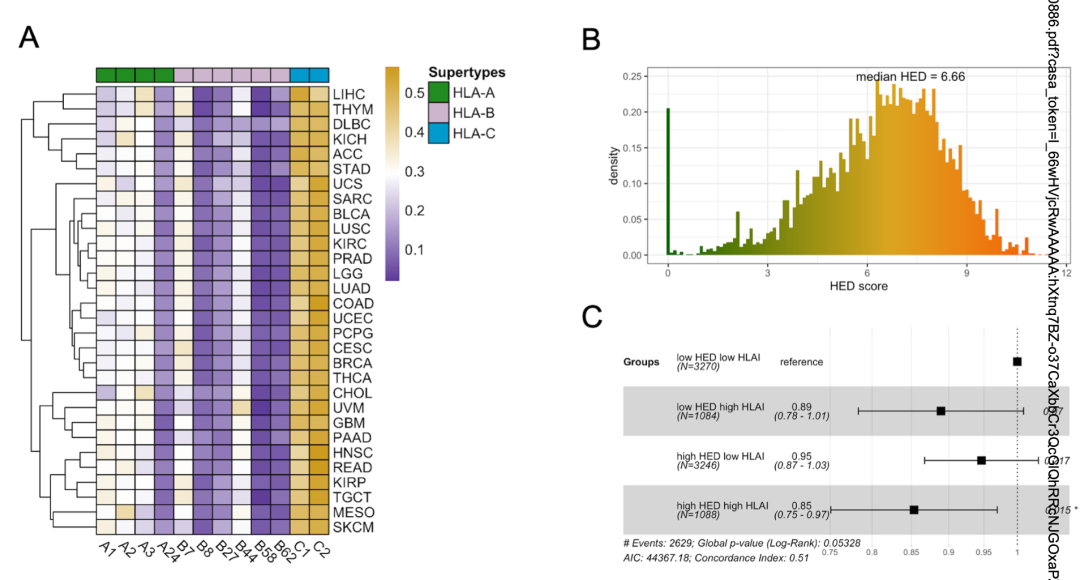
图2 HLA亚型和一致性
4. HLA在免疫亚型和致癌通路中的差异表达
作者根据160个免疫表达特征将癌症患者聚为6个免疫亚型(C1-C6)。C5的特征是免疫浸润水平最低,C4和C6预后最差,C2的免疫浸润和肿瘤内异质性(ITH)水平最高,C3的预后最好。HLA I的表达水平在C2中最显著(图3A),HLA II的表达水平在C1和C4中显著下调(图3B)。此外,Cox分析表明HLA II的log2FC较高可以较好的预测患者预后(图3C)。HLA基因的差异表达分析表明,HLA II基因在多条通路中下调表达(图3D)。
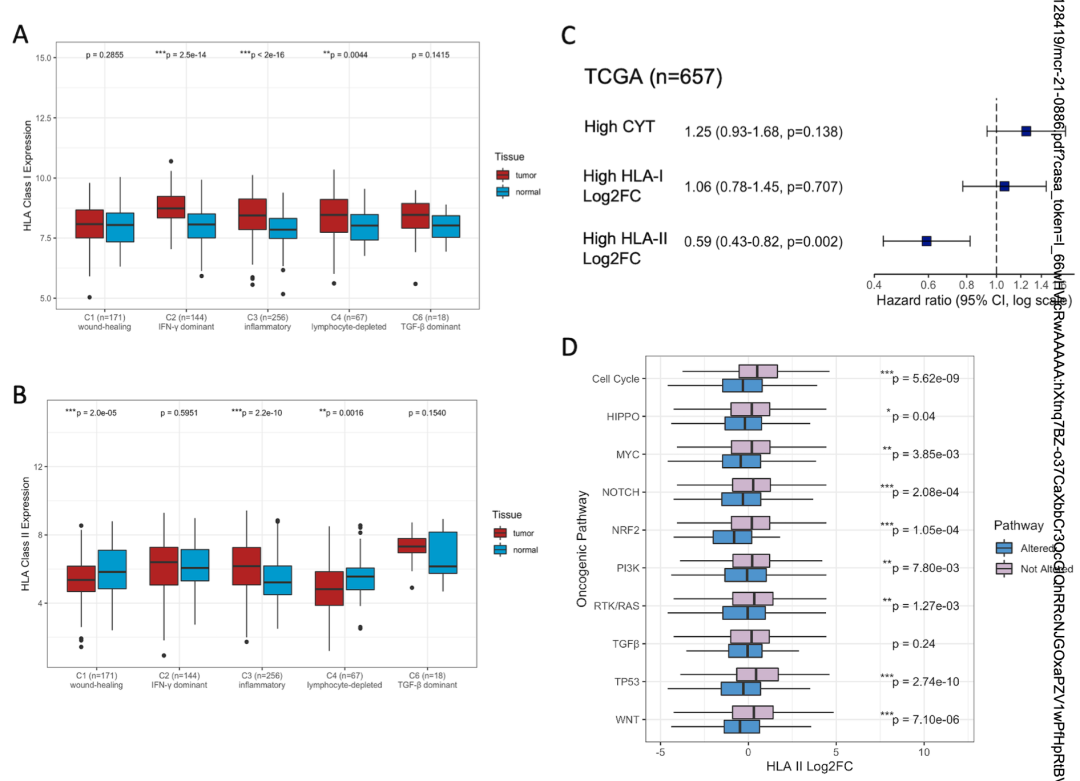
图3 HLA差异表达与免疫亚型和致癌通路的相关性
5. HLA II类基因的上调会缓解受细胞溶解活性影响的HLA I类基因附近的DNA甲基化
作者认为HLA基因的DNA甲基化是一种潜在的HLA介导的肿瘤逃逸策略。总的来说,HLA I类表达与HLA启动子区域和基因体区域的差异甲基化存在显著负相关(图4A)。其中溶细胞活性较高的肿瘤低甲基化程度较高而溶细胞活性较低的肿瘤高甲基化程度较高。在C1和C4中HLA I类的启动子甲基化较高(图4B),C2中HLA I类启动子甲基化较高(图4C),HLA II上调与HLA 启动子低甲基化相关(图4D)。
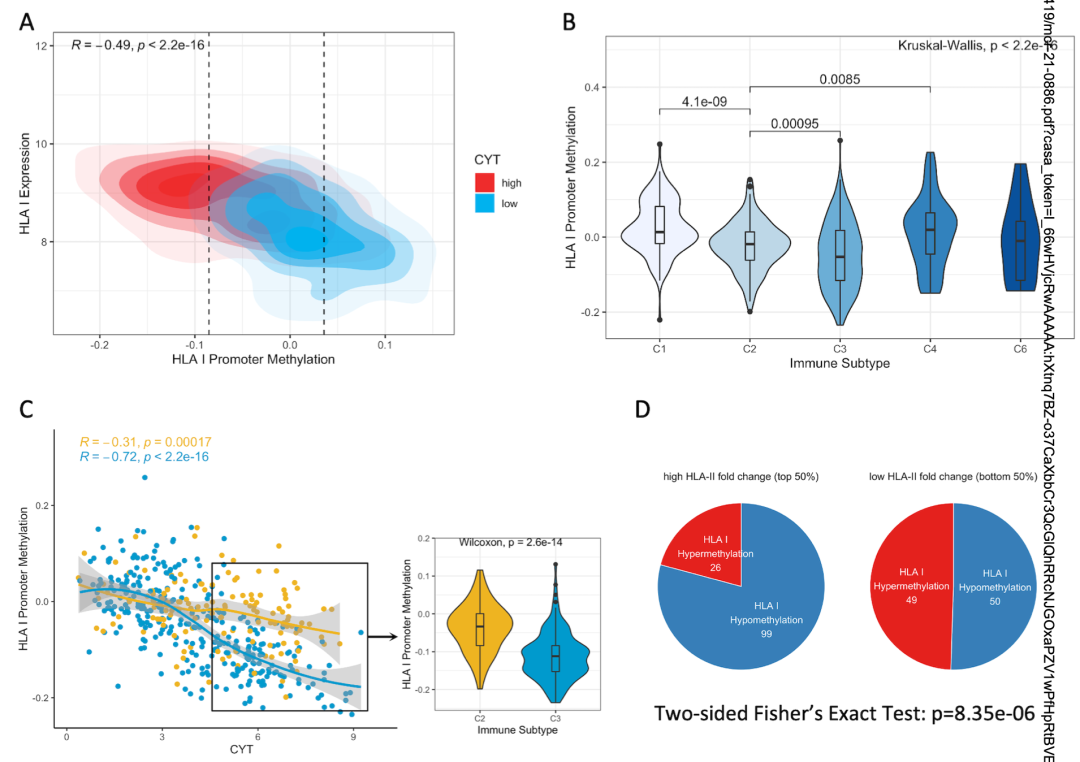
图4 HLA I类甲基化有利于hot肿瘤中病抑制免疫活性
6. HLA杂合性缺失(LOH)与OS较差有关,但可以通过HLA高表达缓解
接下来,作者研究HLA的杂合性缺失(LOH)并评估其与HLA表达和患者生存期的相关性。作者主要研究BRCA,LUAD和SKCM三种癌症类型。分析表明,溶细胞活性较高的肿瘤具有较多的HLA LOH(图5A)。在所有免疫亚型中,C2亚型的HLA LOH比例最高而C3亚型的HLA LOH比例最低(图5B)。此外,HLA I类的拷贝数和基因表达水平之间没有相关性(图5C)。与患者生存水平的相关性分析表明,发生HLA LOH的HLA I类低表达患者的生存率较低,但是HLA I类高表达患者则没有这种现象(图5D)。

图5 HLA LOH分析
6. 机器学习模型预测具有预后潜力的免疫亚型
最后,作者使用随机森林算法对HLA I类和HLA II类基因进行训练并预测6种免疫亚型。该模型预测免疫亚型的AUC为0.93(图6A),其中C3和C5的分类准确率最高而C6的分类准确率最低。接下来,作者使用随机森林分类器对103例患者进行训练并分类免疫亚型,各个免疫亚型的HLA表达水平分析表明,C4亚型中HLA表达水平最低而C2和C3的HLA表达水平最高(图6B)。生存分析表明,不同亚型的患者OS不同(图6C)。溶细胞活性分析表明,C2的溶细胞活性最高(图6D)。
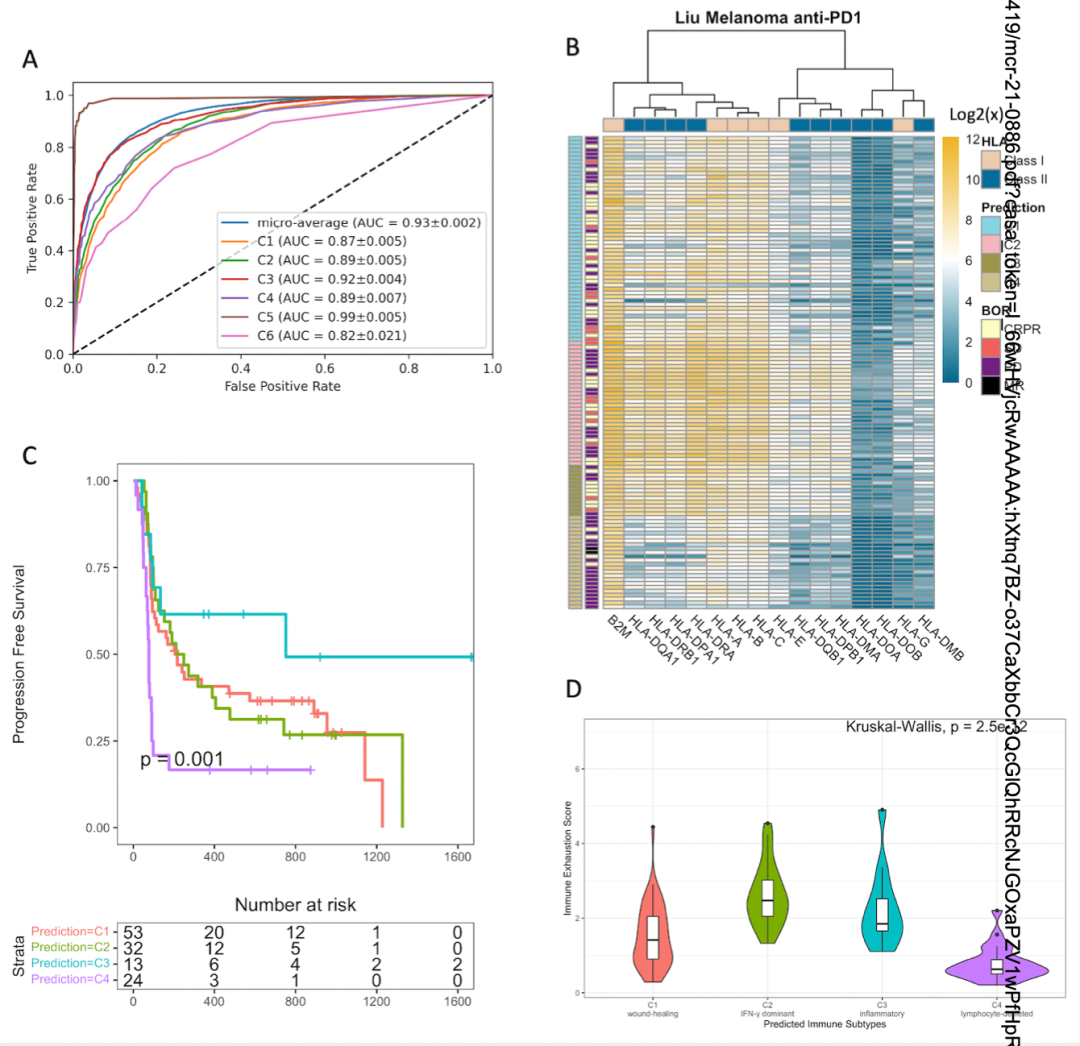
图6 HLA表达水平预测免疫亚型和患者生存分层
结论
本研究作者旨在通过TCGA的泛癌数据集研究HLA表达与免疫微环境和免疫逃逸的相关性。此外,作者基于随机森林算法构建可以预测免疫亚型和患者生存期的模型。作者的研究表明HLA的差异调节在促进肿瘤中延长免疫反应和提高生存的重要作用。然而,本研究的局限性在于作者进使用了HLA的表达数据并没有考虑翻译后修饰,可能不能准确捕捉细胞表面HLA分子表达水平。
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2022-10-03,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读

