发文新方向:免疫+自噬基因构建肿瘤预后模型
导语
免疫治疗结合自噬的潜在靶标和肿瘤预后生物标志物仍然未知。
背景介绍
今天小编为大家带来一个新的生信发文方向,免疫结合细胞死亡基因集构建肿瘤预后模型。文章题目为Identification of a Novel Defined Immune-Autophagy-Related Gene Signature Associated With Clinical and Prognostic Features of Kidney Renal Clear Cell Carcinoma。

研究设计
数据介绍
使用GEO数据库的GSE186645数据集鉴定KIRC中免疫自噬相关的差异表达基因(IAR-DEGs)。
从ImmPort数据库下载1793个人类免疫相关基因(IRG),从人类自噬数据库(HADb)下载223个人类自噬相关基因。
结果解析
01
鉴定肾透明细胞癌中的免疫自噬基因
在GSE168845数据集中筛选1826个上调差异表达基因和1809个下调差异表达基因(图1A)。通过维恩图分析来自ImmPort数据库的1793个人类免疫相关基因和来自HADb的223个人类自噬相关基因,并得到5个共表达基因:CANX,MAPK1,BIRC5,NAMPT和BID(图1B)。
GO/KEGG富集分析发现五个共表达的差异基因在生物过程(BP)中富集“衰老”;细胞成分(CC)中的“树突细胞质”,“神经元投射细胞质”和“质膜投射细胞质”;和分子功能(MF)富集“MAP激酶活性”,“MAP激酶活性”和“死亡受体结合”。KEGG中的五个共表达基因主要富集在“铂类耐药性”,“细胞凋亡”和“多物种凋亡”(图1C)。
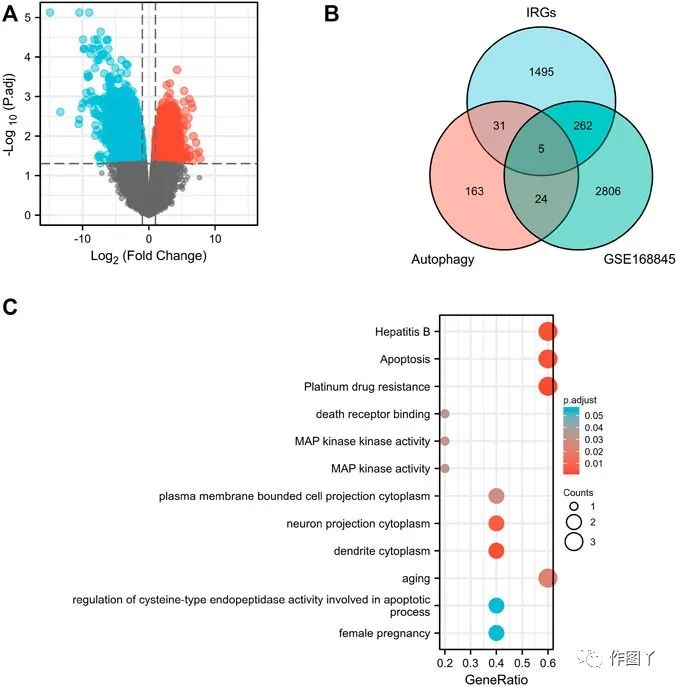
图1
02
免疫自噬相关基因的差异表达和生存分析
在TCGA-KIRC数据库中比较CANX,MAPK1,BIRC5,NAMPT和BID在正常肾脏组织和肾透明细胞肿瘤组织中的表达水平。结果显示,这些基因在肿瘤组织中的表达水平上调(图2A)。
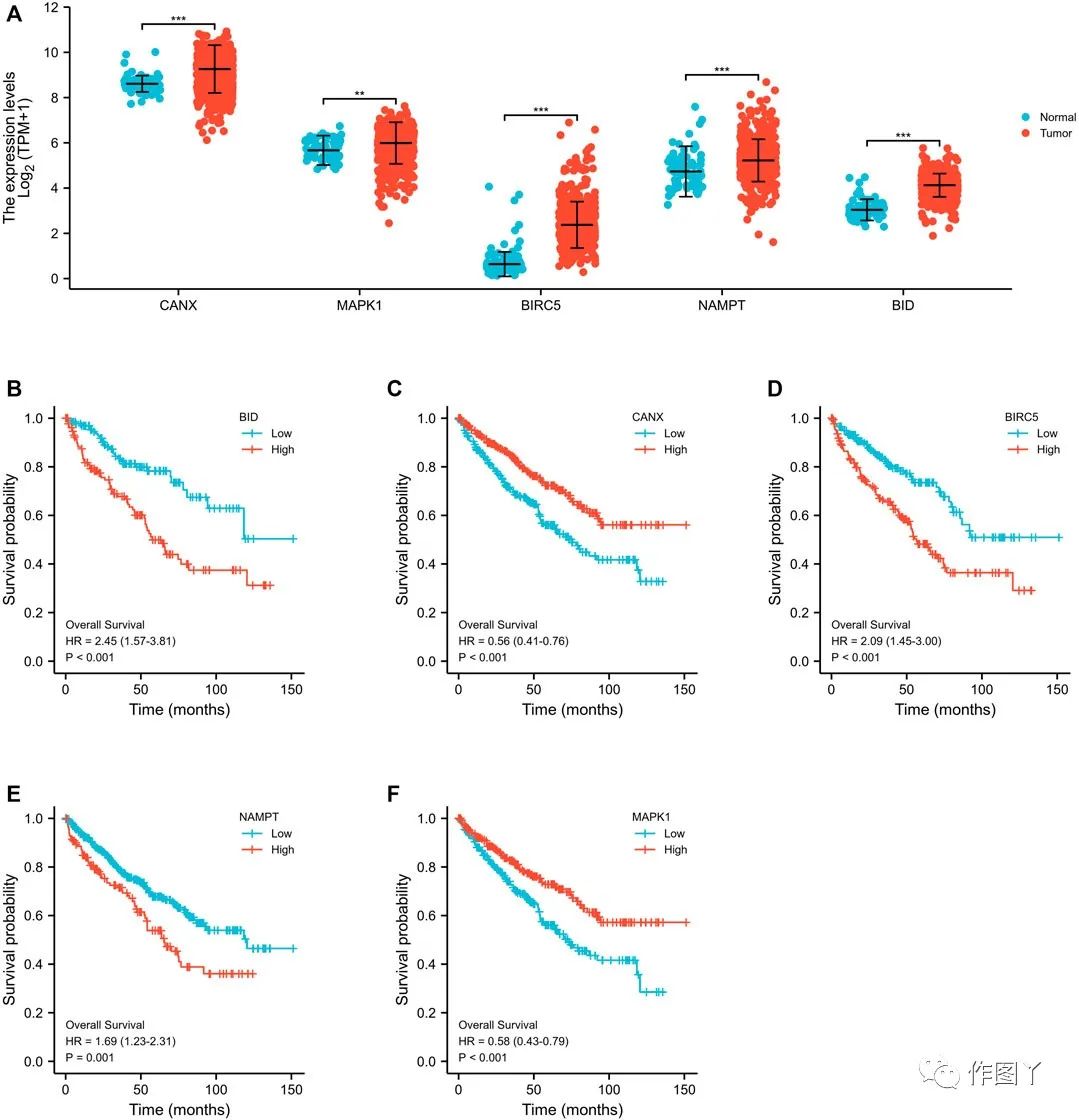
图2
Kaplan-Meier分析表明,上述5个基因的表达水平与预后显著相关,CANX和MAPK1的高表达与预后良好相关(图2C,F),BID、BIRC5和MAPK1的高表达与预后不良相关(图2B、D、E)。使用单变量cox回归分析(图3A)和多变量cox回归分析进一步探讨五个差异表达基因与预后之间的相关性,结果表明CANX,BIRC5,NAMPT和BID是KIRC的独立预后因素(图3B)。
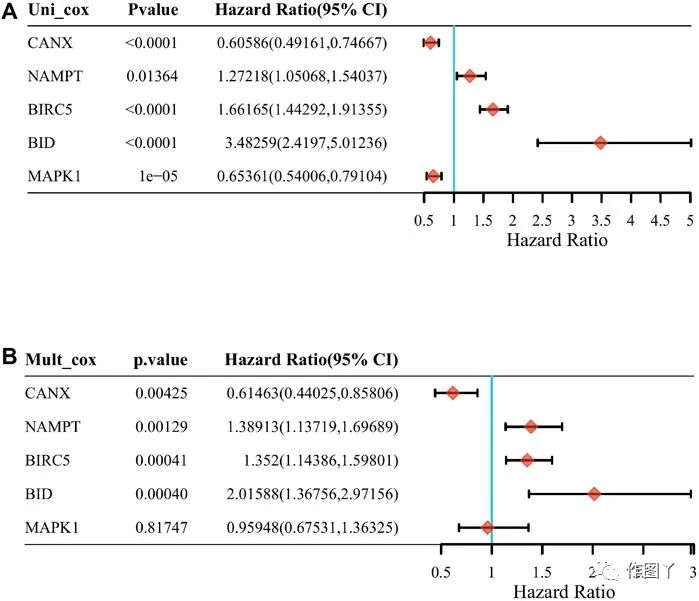
图3
03
免疫自噬基因构建预后模型
使用 lasso cox回归来构建免疫自噬相关基因的预后模型,风险评分= (−0.4879) * CANX + (0.3075) * NAMPT + (−0.3041) * BIRC5 + (0.694) * BID(图4A-B)。根据中位风险评分(50%),患者分为高风险组和低风险组。
BID、BIRC5和NAMPT在高风险组中高度表达,而CANX在高风险组中表达得很低(图4C)。高危组的中位生存时间显著低于低危组(图4C)。使用 ROC评估了模型的预后预测效率,结果显示AUC为0.73(1年OS)、0.685(3 年)和0.697(5年)(图4C)。
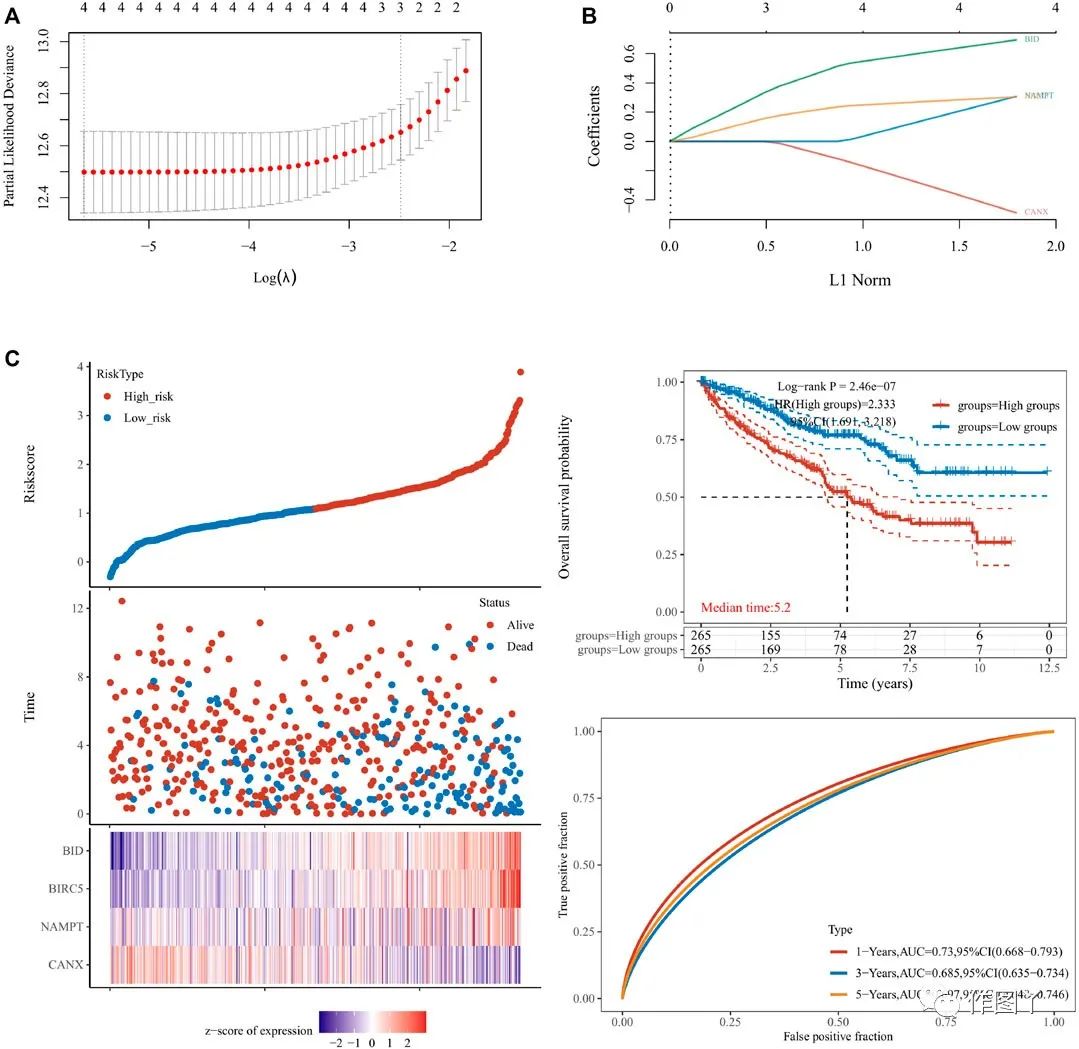
图4
04
免疫自噬基因与临床特征
与T期,N期,M期和病理期相关的免疫自噬相关差异表达基因为BIRC5和BID(图5A-D),与患者性别相关的基因为BIRC5(图5E)。
使用列线图来预测TCGA队列中的1年,3年和5年总体生存(图5G)。列线图上的1年、3年和 5年生存与预测概率的校准曲线一致,1年生存最高(图5H)。
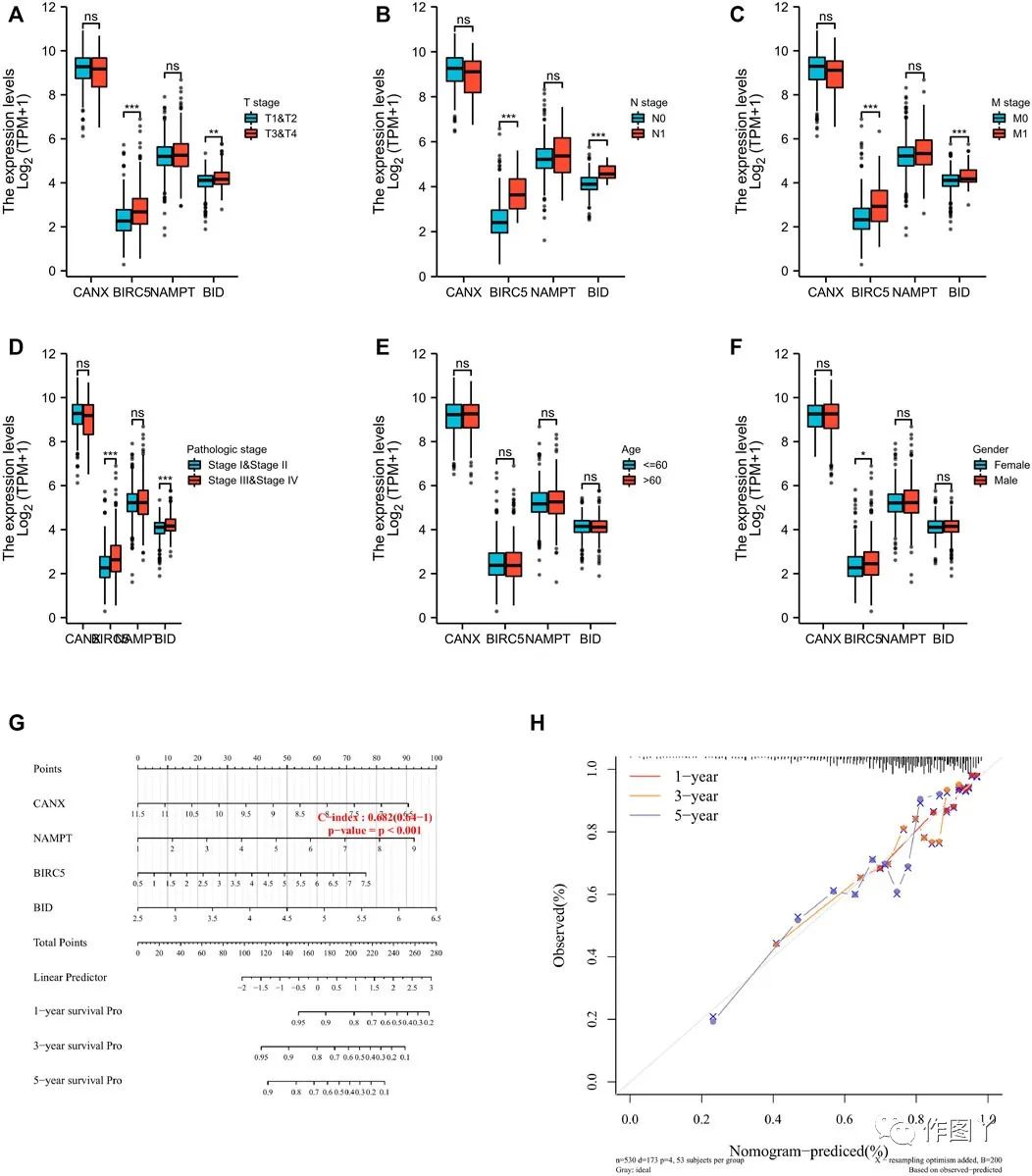
图5
05
GSEA分析
使用基因集富集分析(GSEA)来分析TCGA-KIRC数据库中的KIRC患者数据。结果表明,BIRC5和BID均介导离子通道转运(图6A,B),NAMPT和CANX均介导NABA分泌的通道(图6C,D)。
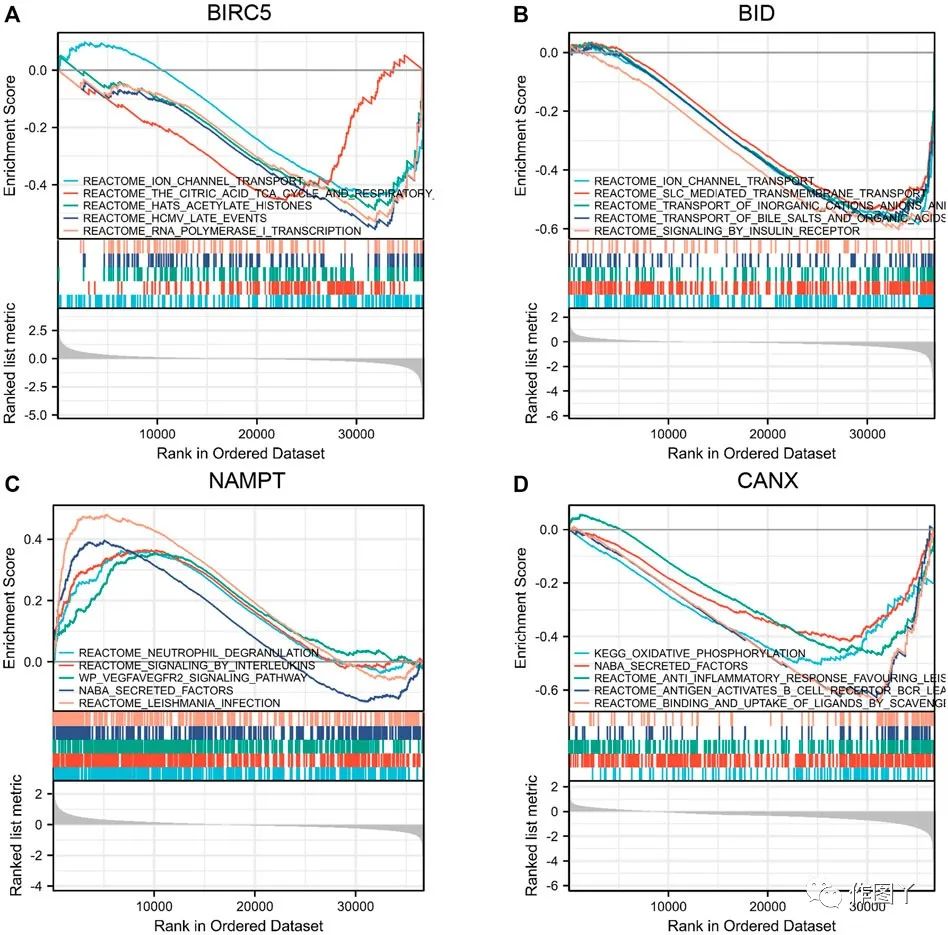
图6
06
免疫自噬基因与免疫浸润
将TCGA-KIRC数据库中的KIRC群体分为免疫自噬相关基因低表达组(G1)和免疫自噬相关基因高表达组(G2),分析了其与免疫浸润细胞表达的相关性。结果表明,CANX、NAMPT、BIRC5和BID与多种免疫浸润细胞的表达水平高度相关,单核细胞、髓突状细胞和CD8+效应记忆T细胞的表达水平与CANX、NAMPT、BIRC5和BID显著相关。这些细胞可能与KIRC的进展有关(图7)。
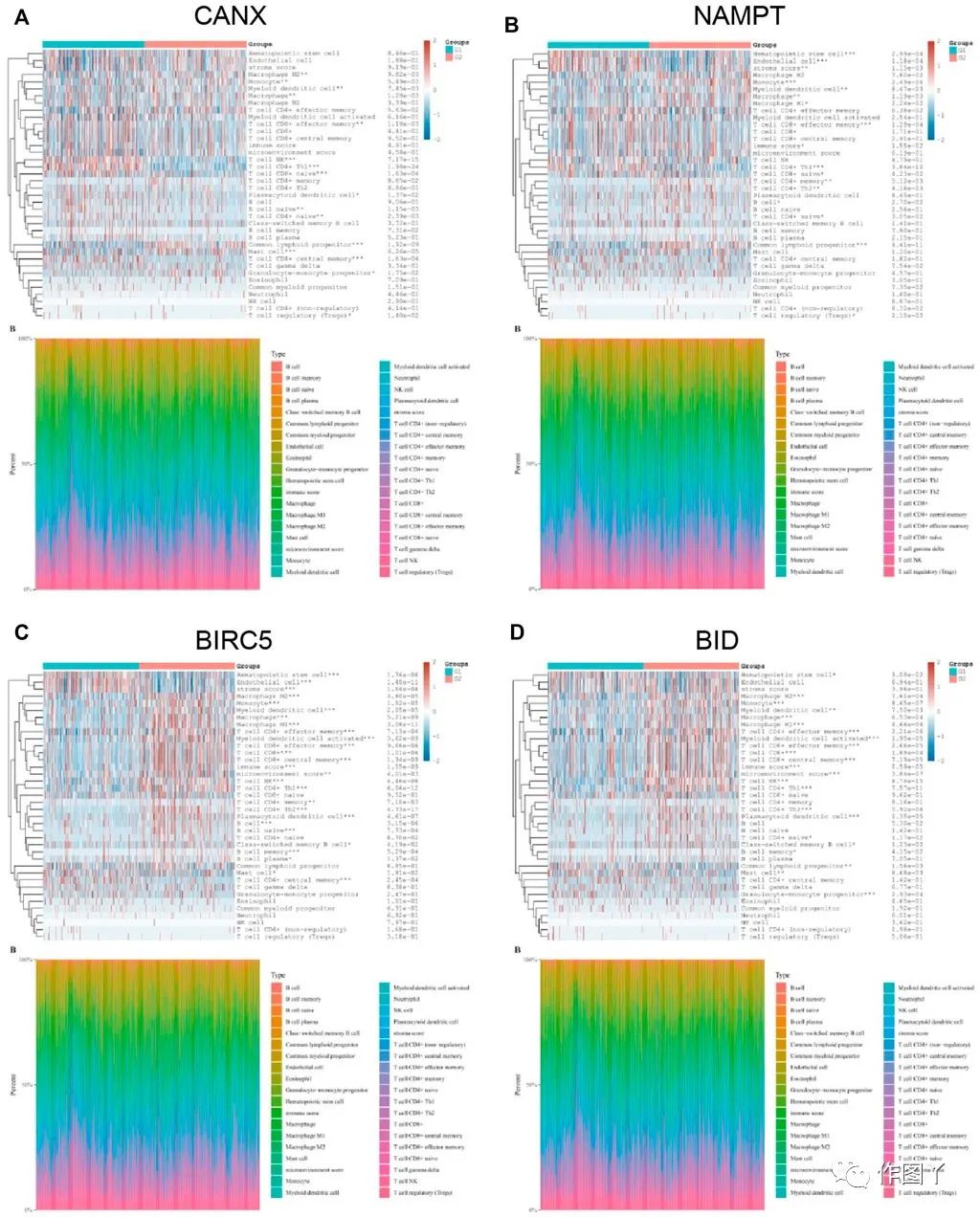
图7
07
免疫自噬基因与免疫检查点
作者分析了KIRC组织中免疫检查点的表达水平与免疫自噬相关差异表达基因表达的相关性。结果表明,CD274、HAVCR2、LAG3和PDCDILG2与BID显著相关(图8A)。CD274和PDCDILG2与BIRC5显著相关(图8C)。CTLA4、LAG3、PDCD1、PDCDILG2、TIGIT和SIGLEC15与CANX显著相关(图8G)。这些基因是用于KIRC治疗和诊断的敏感免疫检查点。
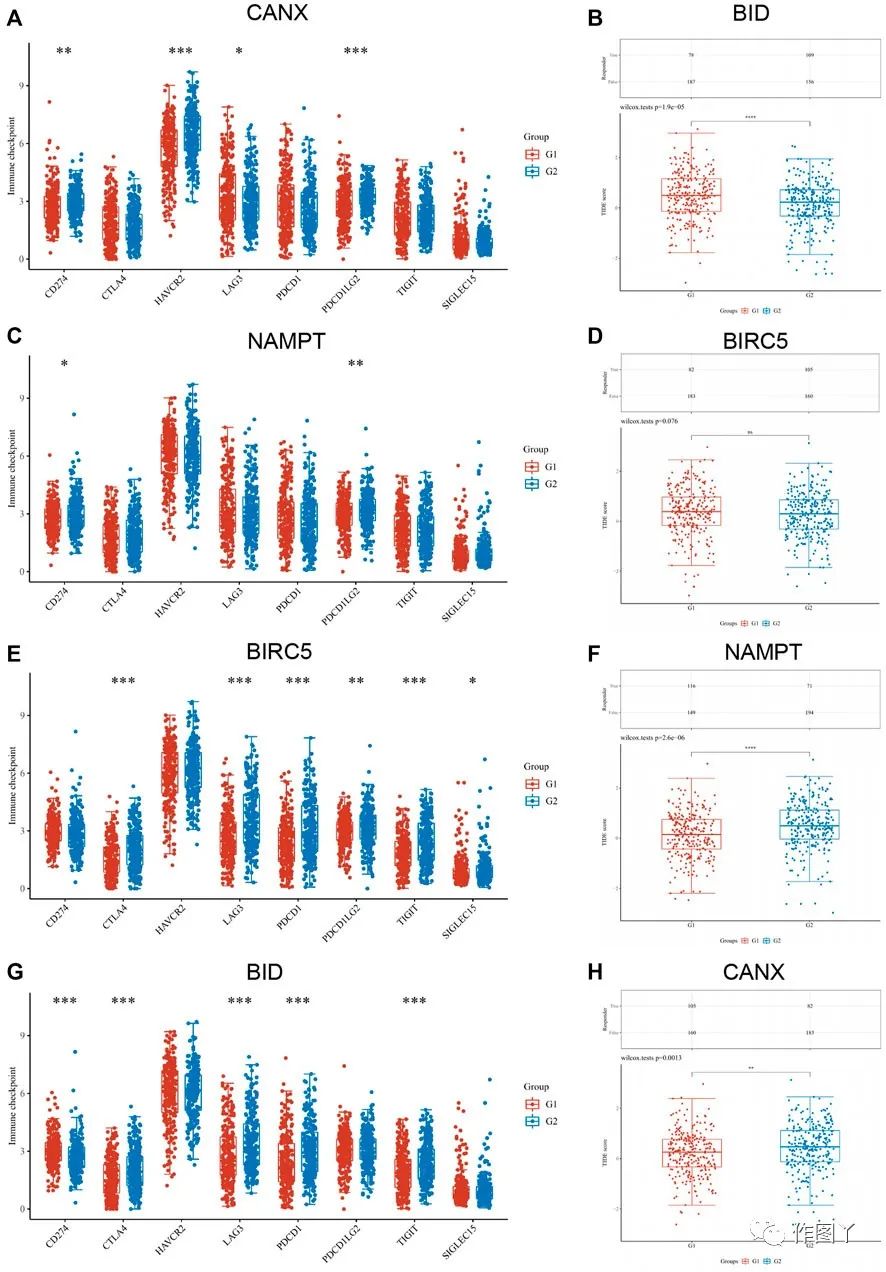
图8
此外,基于肿瘤免疫功能障碍和排除(TIDE)算法预测了具有不同表达水平的CANX,BID,NAMPT和BIRC5对免疫检查点抑制剂的反应(图8B-H)。结果表明,除NAMPT外,所有免疫自噬相关基因的p值均为<0.05,表明免疫检查点抑制剂对CANX、BID和BIRC5表达量高的KIRC有效,免疫检查点抑制剂治疗后存活期延长。
08
免疫自噬基因与甲基化、铁死亡
免疫自噬相关基因的表达与多个铁死亡相关基因的表达水平相关,NCOA4、EMC2、NFE2L2、HSPB1、SAT1和DPP4与CANX、NAMPT、BIRC5和BID显著相关。
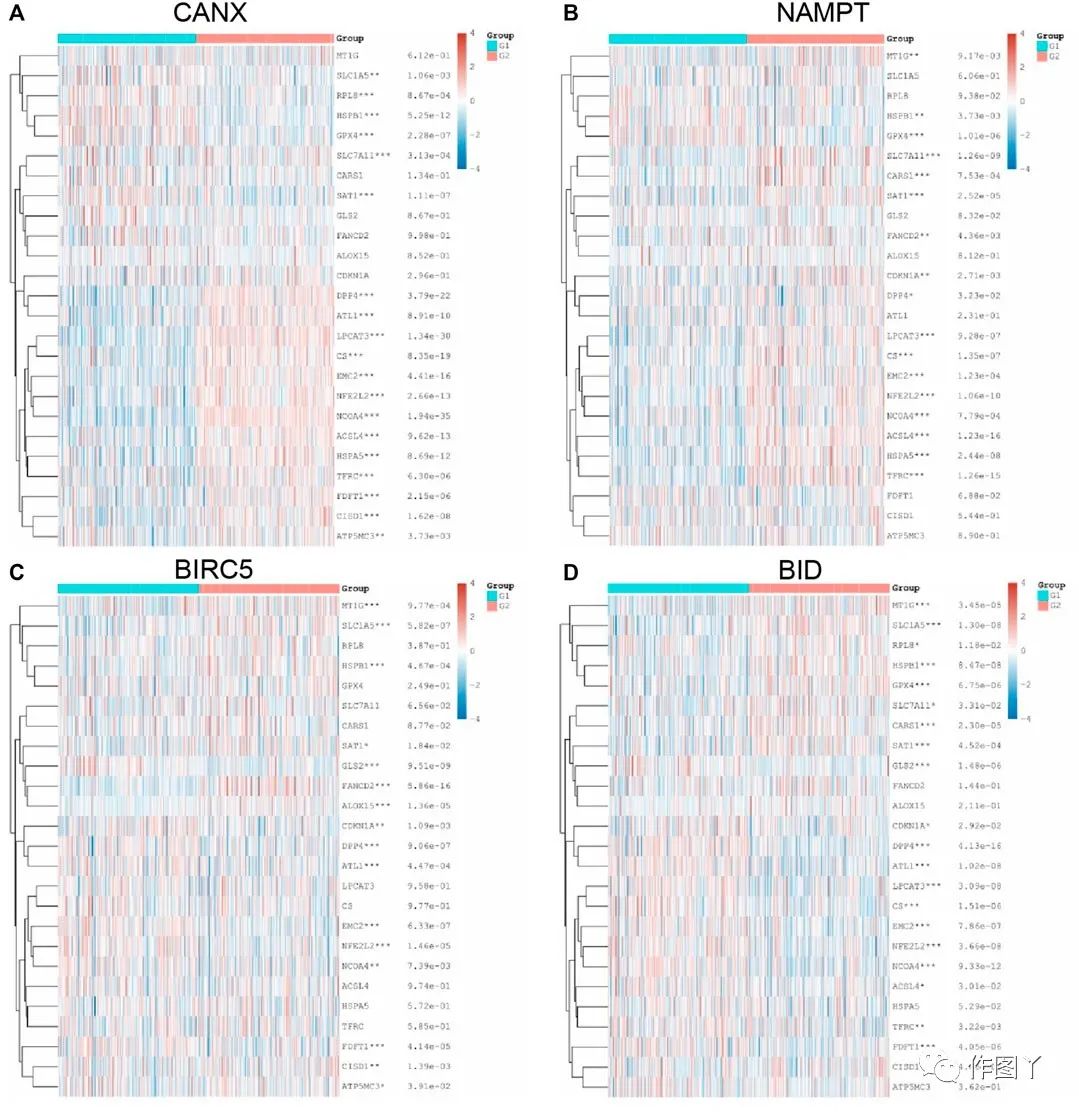
图9
此外,还分析了m6A甲基化相关基因和免疫自噬相关基因的相关性。发现CANX,NAMPT,BIRC5和BID与多个甲基化基因显著相关(图10)。作者进一步验证了m6A相关基因在肾癌和正常组织中差异表达,与患者预后有统计学意义相关。METTL14、VIRMA、ZC3H13、YHDC2、YTHDF3、YTFDF2、IGF2BP 和RBMX与4种免疫自噬相关差异表达基因显著相关。
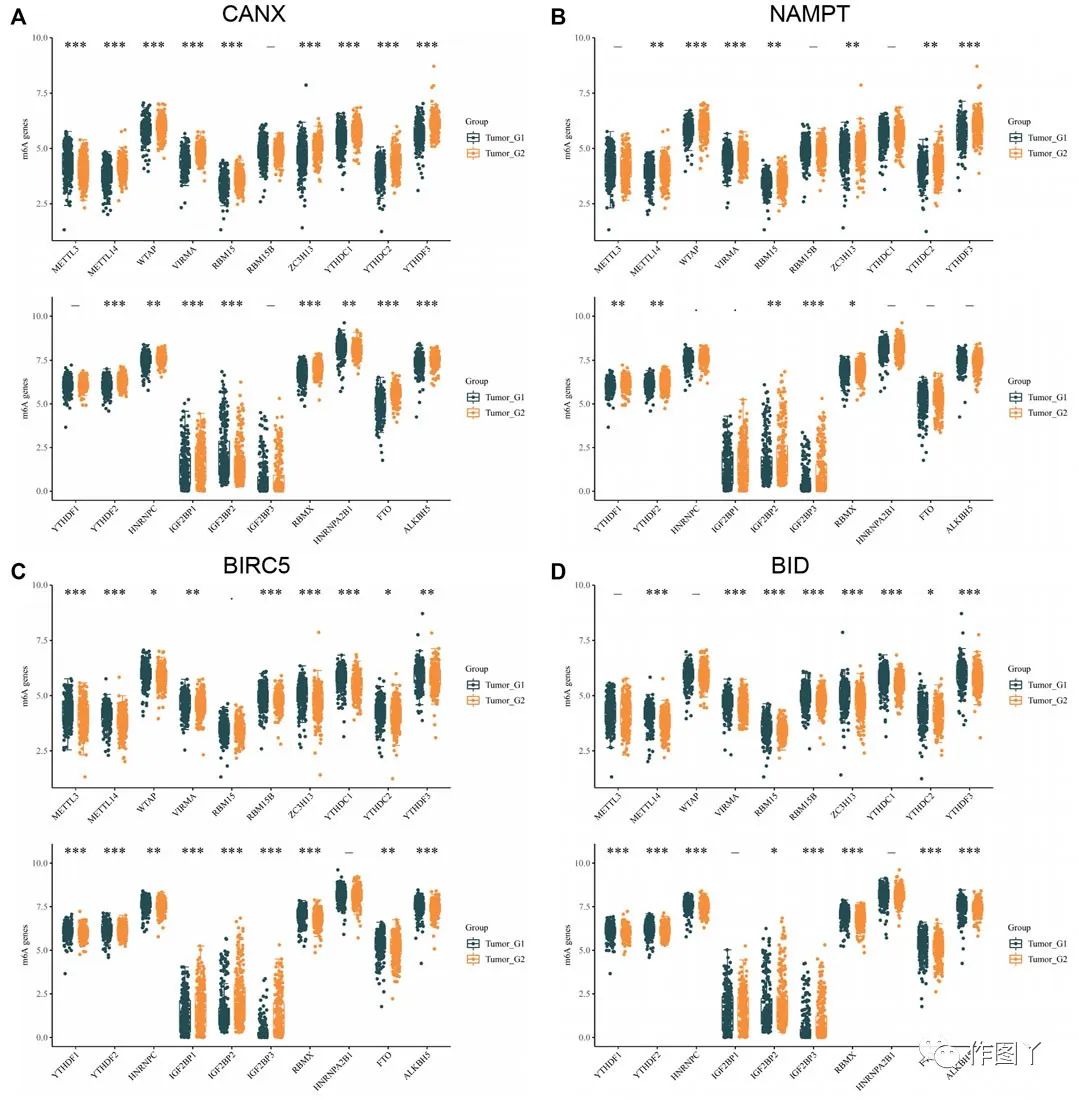
图10
09
免疫自噬基因的单类逻辑回归评分
通过one-class logistic regression (OCLR)评分发现,除BID外,CANX,NAMPT和BIRC5的表达水平与KIRC的干燥度显着不同(图11)。这些结果表明,CANX,NAMPT和BIRC5可能会影响KIRC细胞和干细胞之间的相似程度,从而影响肿瘤的BP和去分化程度。
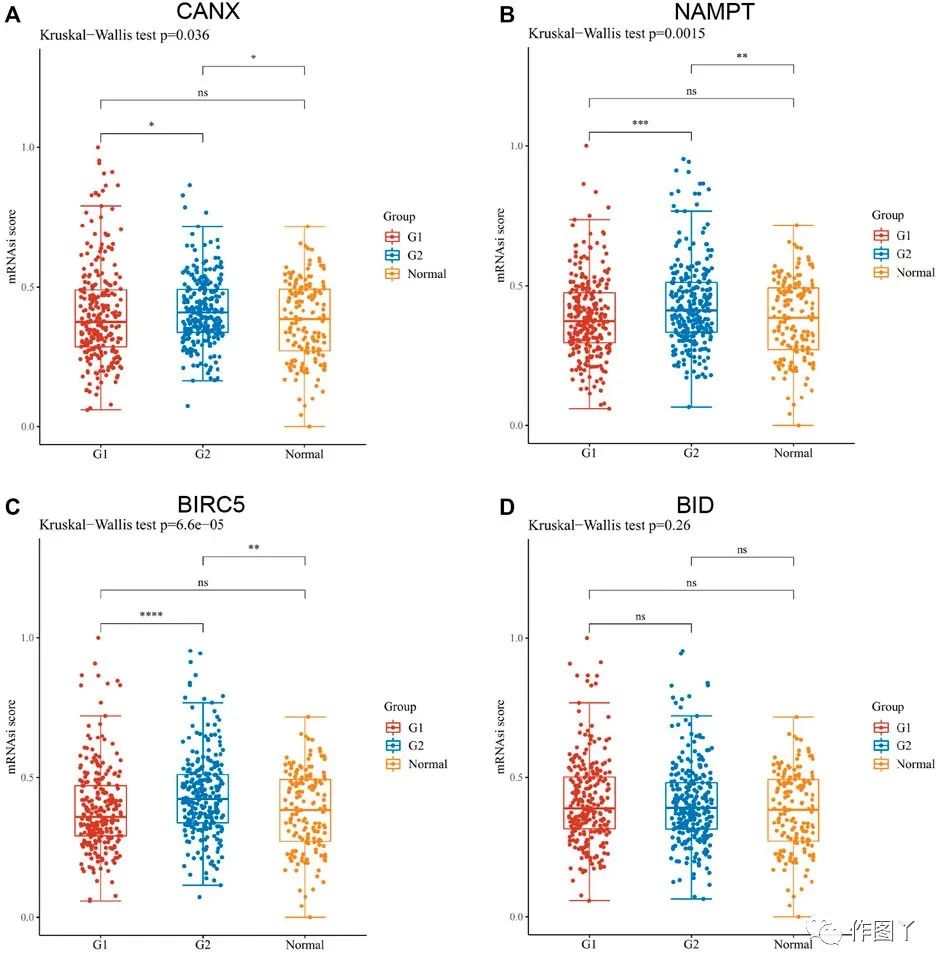
图11
10
实验验证差异表达
为了检测四个基因(CANX,BID,NAMPT和BIRC5)在KIRC中的表达,在KIRC细胞和临床组织样本中进行了qRT-PCR。验证了正常肾细胞系(HK-2细胞)和两个KIRC细胞系(786-O和caki-1)中四个基因的表达水平。结果显示,与正常肾细胞相比,KIRC细胞中四个基因的表达水平显着增加(图12A–D)。
此外,蛋白质印迹结果显示,在RCC细胞系786和caki-1中,NAMPT和BIRC5的蛋白质水平在升高的水平下表达,但在BID和CANX的蛋白质水平上没有显着差异(图12J)。在肿瘤组织和相邻的正常肾组织中检测到BID,NAMPT和BIRC5具有相同的结果,而CANX没有显着差异(图12E-H)。
最后,通过免疫组化(IHC)检测组织中BID,NAMPT和BIRC5的蛋白质表达。结果表明,与邻近的正常肾组织相比,KIRC组织中的NAMPT和BIRC5显著增加。然而,BID在大多数组织中为阴性(图12I)。
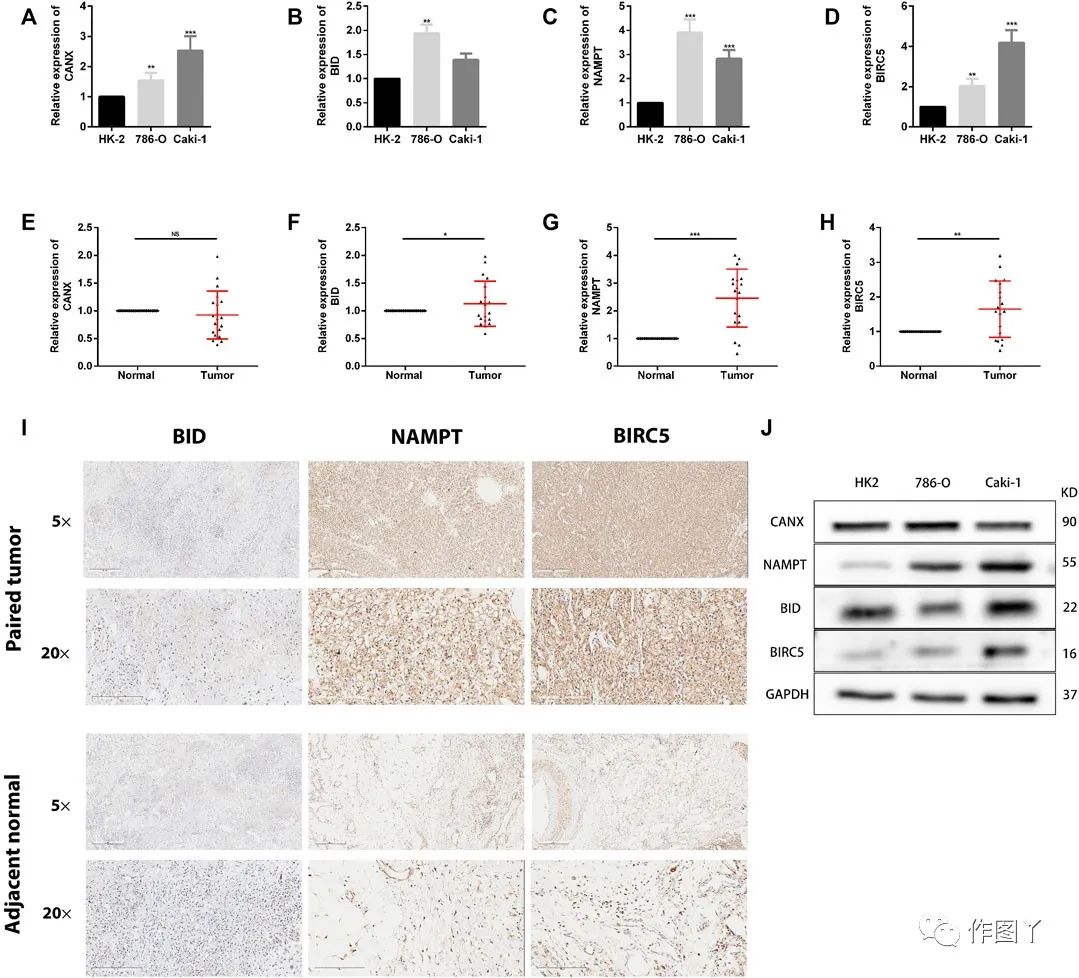
图12
小编总结
本文首先从GSE168845,ImmPort数据库和HADb中的基因中获得了5个共表达的免疫自噬相关差异表达基因,并在进行多变量Cox回归分析后删除了MAPK1。作者发现,肿瘤组织中CANX、BIRC5、BID和NAMPT的表达水平均显著高于其在正常组织中的表达水平,表明它们均与肿瘤的发生和发展显著相关。随后建立的K-M模型表明,BID和BIRC5高表达的患者预后较差。相比之下,CANX高表达的患者预后较好,这与用lasso Cox回归构建的差异表达相关风险预后模型的结果一致。为了更好地理解这四种免疫自噬相关差异表达基因与肿瘤的相关性,作者还统计分析了它们与肿瘤分期、组织病理学形态、患者年龄、患者性别和其他临床病理特征的相关性。此外,校准曲线和列线图显示出良好的预测效果。免疫自噬相关差异表达基因的表达水平也与免疫浸润、免疫检查点、甲基化和铁死亡显著相关。在这些结果中,BIRC5和BID的表现尤为突出,免疫浸润细胞如单核细胞、髓突状细胞、CD8效应记忆T细胞、免疫检查点CD274等值得特别关注。此外,在临床样本中进行了qRT-PCR和IHC,发现与相邻正常组织中相比,ccRCC组织中NAMPT和BIRC5的表达显著更高。
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2022-11-02,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读


