同时阻断 ERK 和自噬过程的药物抑制剂组合有望治疗 PDAC | MedChemExpress
原创同时阻断 ERK 和自噬过程的药物抑制剂组合有望治疗 PDAC | MedChemExpress
原创
MedChemExpress
发布于 2023-02-21 14:26:02
发布于 2023-02-21 14:26:02
胰腺导管腺癌(PDAC)的特征是 KRAS- 和自噬依赖的致瘤生长,但 KRAS 在自噬中的作用尚未确定。研究人员使用之前已验证过的 siRNA 寡核苷酸链 23 进行急性 KRAS 的抑制,发现其可在 7 个 KRAS 突变的人类 PDAC 细胞系中的 6 个增加2~10 倍的自噬通量。与此同时,还发现使用 RAS 抑制剂 ARS-1620 治疗 KRAS g12c 突变的 MIA PaCa-2 细胞,可导致自噬通量的类似增加。随后,研究人员通过免疫印迹等实验,证明 KRAS 的抑制会增加 KRAS 突变型 PDAC 细胞系中的自噬通量,表现为自噬体形成、溶酶体融合和自噬体相关 LC3B-II 的增加(如 Figure 1.所示)。
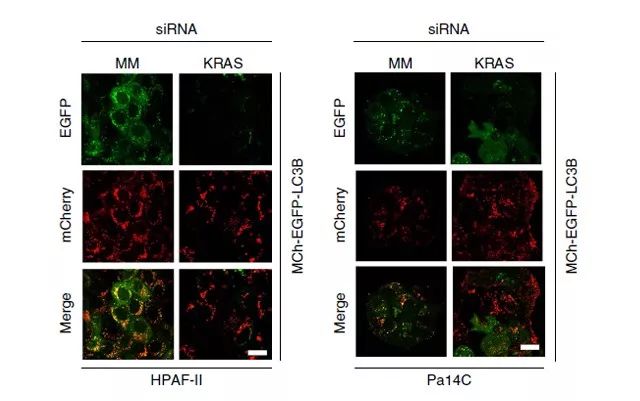
Figure 1.KRAS 抑制增加 KRAS 突变 PDAC 细胞系的自噬通量
研究人员发现,在做检测的 8 个人源 PDAC 细胞中,所有细胞均能稳定的表达 mCherry-EGFP-LC3B 自噬载体,并在 ERK 抑制剂(SCH772984)使用的短期(24 小时)内,可刺激细胞在自噬方面出现 3-30 倍的增长。为了证实自噬通量的增加,研究人员观察到在 ERK 抑制剂(SCH772984)处理细胞中 LC3B-II 和 LC3B-I 的比例相较于对照组,无论是在基础情况下,还是在 bafilomycin A1 存在的情况下,都可以抑制通量。将这些结果扩展到 iKRAS 模型,我们观察到 ERK 的抑制也抑制了实验检测的三种小鼠 iKRAS PDAC 系中三种的 Kras G12D 沉默,导致自噬通量广泛增加 10- 30 倍(如 Figure 2.所示)。
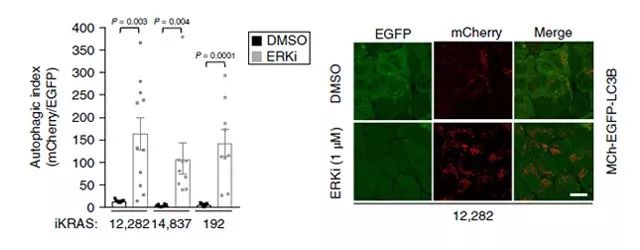
Figure 2. ERK 的抑制提高自噬通量
值得注意的是,我们进一步证实了 ERK 的抑制能够刺激 AMPK 的激活,且观察到 mTORC1 信号下降。RPPA 数据的相关分析证实,磷酸化 AMPK 水平与 ERK 抑制的标志物呈负相关,而 mTOR 通路成分的减少与 ERK 抑制的标志物呈正相关。随后,研究人员利用液相色谱、 q-RTPCR 等实验方式,证明 ERK 的抑制会增强自噬,并提高自噬信号、核苷酸代谢和基因转录大水平(如 Figure 3.所示)。
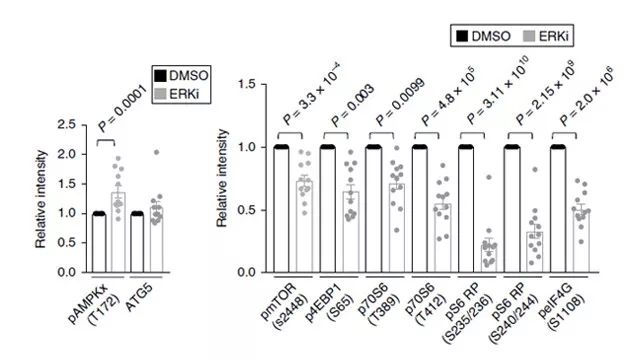
Figure 3. ERK 的抑制对 mTOR 的影响
研究人员发现 ERKi 处理细胞后,胞内线粒体的质量降低,线粒体病理通量增加。ERK 的抑制使人PDAC系(KRAS短期抑制)和 iKRAS 小鼠 PDAC 系(KRASG12D 抑制)的线粒体融合增强。总的来说,ERK 抑制和 KRAS 抑制都显著影响线粒体网络的重排,与通常观察到的碎片化性质相比,更倾向于线粒体的融合。之前有研究表明,线粒体融合与线粒体活性增加有关。然而,在研究过程中,研究人员发现在 ERKi 处理 1.5 h(发现线粒体融合的时间点)的细胞内没有观察到细胞耗氧量的任何变化。此外,ERKi 处理人 PDAC 细胞 24 小时后,细胞的基础耗氧量和 ATP 的产生或降低或不变(如 Figure 4.所示)。
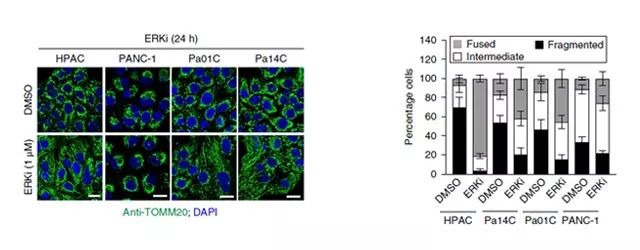
Figure 4. ERK 抑制和 KRAS 沉默损害 PDAC 细胞线粒体功能
鉴于目前临床上还没有特异性的自噬抑制剂,但羟氯喹作为溶酶体酸化的一种间接自噬抑制剂,经常被使用。因此,我们发现与SCH772984同时治疗,ERK (ulixertinib/BVD-523)38 在化学上和机制上明显或 MEK 抑制剂 binimetinib 协同地增强氯喹介导的生长抑制。利用 Chou-Talalay 或 BLISS 的方法,可在大范围的ERKi 或 MEKi 浓度下观察到协同作用。值得注意的是,无论采用 MTT 还是活细胞计数的方式,都能观察到协同作用。与此同时, ERKi 的单独给药有限度的造成细胞凋亡,但联合治疗后细胞明显增加(如 Figure 5. 所示)。
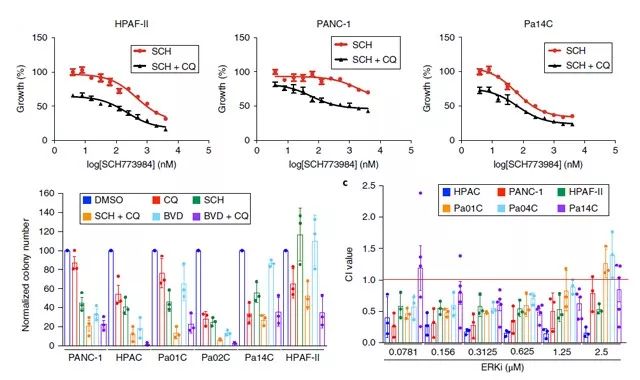
Figure 5.ERK 信号和自噬的双重抑制协同损害 PDAC 增殖
为了将这些体外发现扩展到体内肿瘤生长,研究人员对 ERKi 和羟基氯喹在两种异种 kras 突变的胰腺肿瘤源性异种移植(PDX)模型中的联合应用。在这两种模型中,ERKi 的单独使用对肿瘤生长有显著影响,而两者的结合更加有效地阻止了肿瘤的进展并延长了生存期。此外,ERKi 和羟基氯喹联合治疗的小鼠肿瘤明显小于单独使用 ERKi 治疗的小鼠肿瘤。因此得出结论, 协同抑制 ERK1/ERK2和自噬与单独抑制 ERK 对 PDAC 的抑制作用会更加明显(如 Figure 6. 所示)。
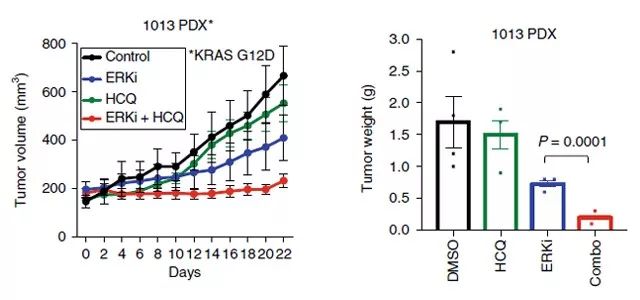
Figure 6.使用 ERKi 和羟基氯喹联合治疗小鼠的影响
小M 的小思考:
北卡大学的研究人员发现,KRAS 的抑制增加了自噬通量,而其效应物 ERK 的药理抑制也增加了自噬通量。此外,还证明 KRAS 的抑制或 ERK 抑制都会导致糖酵解和线粒体功能降低。随后推测,ERK 抑制可能因此增强 PDAC 对自噬的依赖,部分通过破坏其他 KRAS 或 ERK 驱动的代谢过程。进而得出结论,同时阻断 ERK 和自噬过程的药物抑制剂组合有望成为治疗 PDAC 的高效方式。
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
评论
登录后参与评论
推荐阅读

