线粒体 ClpP 介导的蛋白水解作用可选择性诱导癌细胞死亡 | MedChemExpress
原创线粒体 ClpP 介导的蛋白水解作用可选择性诱导癌细胞死亡 | MedChemExpress
原创

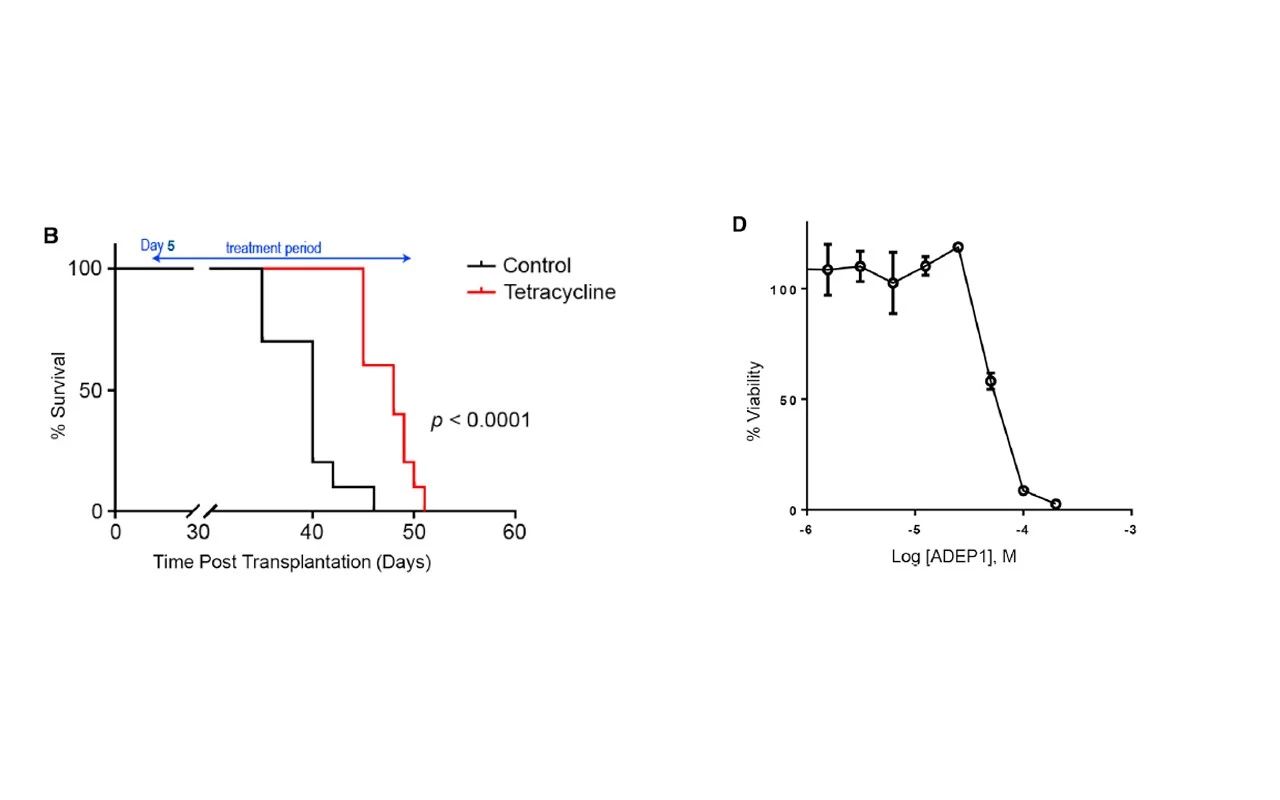
首先,研究人员利用基因工程的方法,在人 ClpP 上建造了一个有持续活性地点突变(Y118A)。基于 OCL-AML3 和 Z138 肿瘤细胞系,研究人员研究 Y118A 点突变对于肿瘤细胞的影响。研究发现,Y118A 点突变对肿瘤细胞的凋亡呈浓度依赖性。将含有点突变 Y118A (四环素-诱导的)的 Z138 细胞系和静脉注射至 NSG 小鼠中,随后给予四环素和溶剂分别处理小鼠。研究发现,四环素处理组的生存周期明显延长。随后,研究人员用 ADEP1 处理 OCL-AML2 细胞,发现它可以明显地减缓细胞的增殖和细胞的活力(如图2. 所示)。
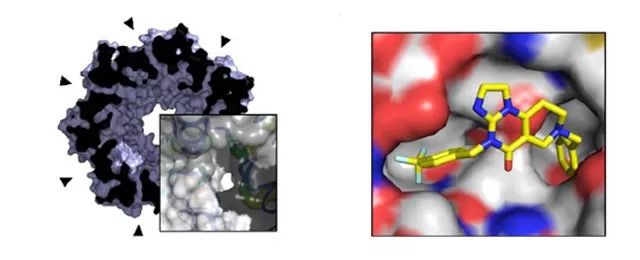
随后, 研究人员发现亚胺普利酮 ONC201 和 ONC212 可有效激活线粒体 ClpP。亚胺普利酮可与 ClpP 相结合,对白细胞和淋巴癌细胞有细胞毒性。亚胺普利酮作为 ClpP 的激活剂通过 ClpP 依赖的方式杀死肿瘤细胞(如图3. 所示)。
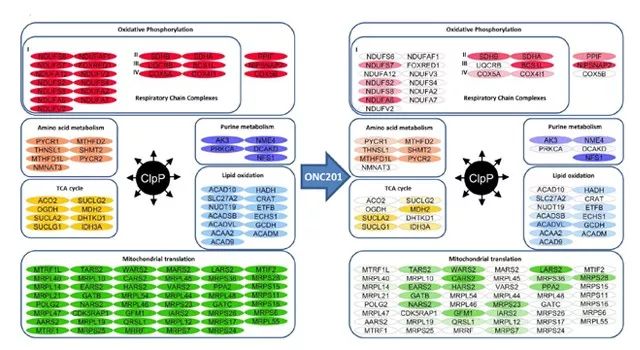
接下来,研究人员使用 BioID 来验证化学或基因激活后 ,与 ClpP 相互作用的因子。用 ONC201(0.6 mM)对表达鞭毛-Clpp (WT) 的 T-REx HEK293 细胞进行 48h 的化学活化处理。实验结果表明,ClpP 超活化后,可减少呼吸链复合体亚单位的数量,从而引起细胞凋亡(如图4.所示)。
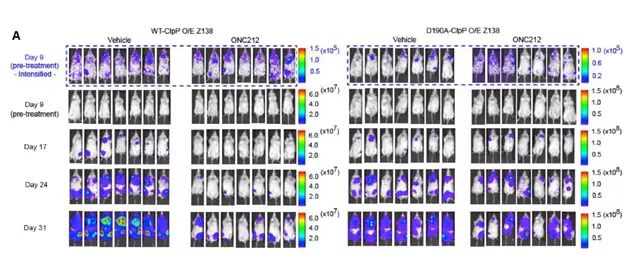
基于体外细胞实验结果已表明,ClpP 的超活化可引起肿瘤细胞的凋亡。研究人员在裸鼠内对亚胺普利酮的生物学效力进行了检测。动物实验结果表明,亚胺普利酮激活ClpP 可使裸鼠体内的肿瘤体积明显减小,延长裸鼠的生存周期。因此,亚胺普利酮激活 ClpP 在体内具有抗肿瘤作用。
参考文献
Ishizawa J, et al. Mitochondrial ClpP-MediatedProteolysis Induces Selective Cancer Cell Lethality. Cancer Cell. 2019 Apr 24. pii:S1535-6108(19)30160-6.
小M 的小思考:
线粒体酪蛋白水解酶 P(ClpP)通过降解错折叠蛋白,在线粒体蛋白质量控制中起着重要作用。通过遗传学和化学方法,Ishizawa 等研究人员发现,蛋白酶的过度激活选择性降解其呼吸链蛋白底物,破坏线粒体结构和功能,而不影响正常细胞的功能,选择性地杀死癌细胞,且该过程与 p53 状态无关。同时发现,亚胺普利酮是 ClpP 的有效激活剂。通过生物化学和晶体学研究表明,亚胺普利酮与 ClpP 非共价结合,并通过不同的结构变化诱导蛋白水解。目前正在进行临床试验。研究人员,提出了通过激活线粒体蛋白水解诱导癌细胞死亡的新方式。
相关产品:
TIC10
TIC10 是一种有效,有口服活性,稳定的 TRAIL 诱导剂,其通过抑制 Akt 和 ERK 起作用,从而激活 Foxo3a 并显着诱导细胞表面 TRAIL。
TIC10 isomer
TIC10 isomer 是 TIC10 的异构体。TIC10 isomer 不具有诱导 TRIAL 表达的生物学活性。
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
