如何使用TCGAbiolinks下载TCGA数据并整理
原创如何使用TCGAbiolinks下载TCGA数据并整理
原创
引言
一般来讲,我们想要使用TCGA数据,大概有三种方法,一是直接从GDC官网或官方下载工具gdc-client下载文件后自行处理,二是使用数据库如UCSC Xena或Firehouse,三是使用TCGAbiolinks R包自动下载并处理。
从官网下载并不麻烦,但是第一是需要选取非常多的自定义选项,第二是网络环境不好会容易中断,对于初学者倒是一个非常好的了解生物信息学的途径,但遇到批量化处理需求的时候就会难以进行。其后是数据库法,数据库虽然方便,但是并不会随着官网的更新变动,如 GDC Xena Hub 最后一次更新时间是 2019-08-28 , Firehose 更是停留在了更遥远的 2016_01_28 ......
那么, 如果我需要批量下载的话, 难道我需要一个个的从网页加入Cart获取mata吗, 我不要......
幸好,已经有人造了非常好用的轮子,当然可以轻松学习一下用起来啦。
TCGAbiolinks 包是从TCGA数据库官网接口下载数据的R包。它的一些函数能够轻松地帮我们下载数据和整理数据格式。其实就是broad研究所的firehose命令行工具的R包装!
需要注意的是,2022年TCGA数据库进行了一次比较大的更新,其中包括了数据格式的变动,因此 TCGAbiolinks 也必须随之更新到最新版。下面,正式开始。
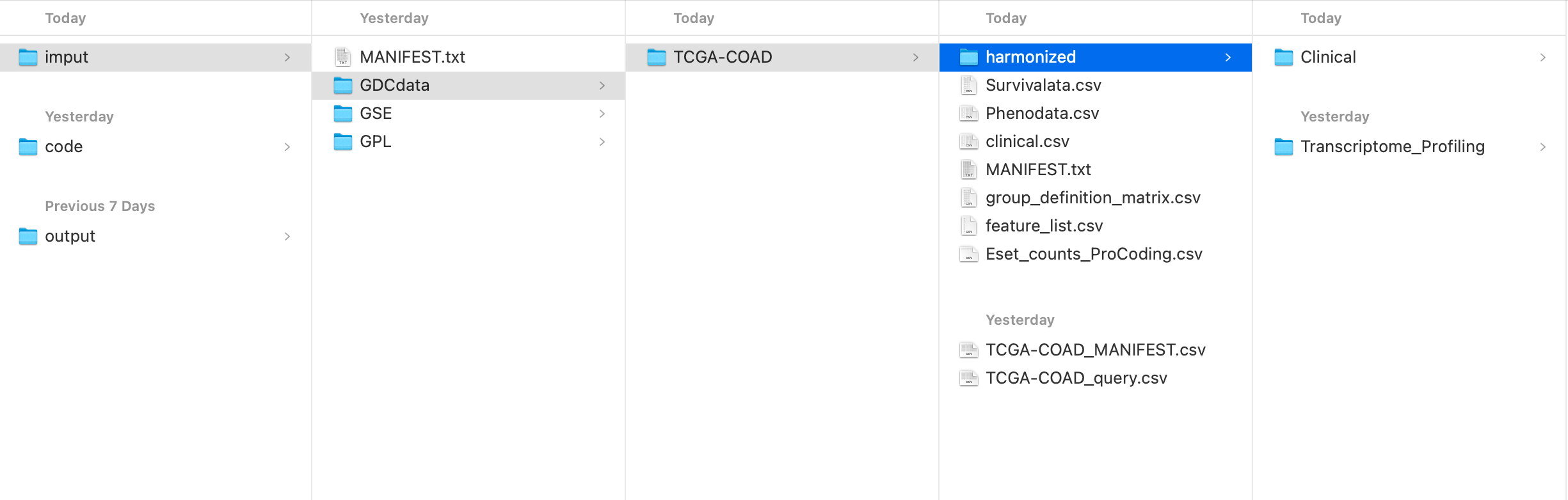
效果展示
可获得文件如下:
- TCGA转录组数据原始文件(tsv)及临床原始文件(xml), 均附带清单
- 表达矩阵表格(可选
"counts", "fpkm", "tpm") - 分组文件
- 临床数据, 其中包含生存数据
过程
下载
首先是更新最新版的 TCGAbiolinks 包, 我使用的办法是使用Clash获得本地代理后对 R session 进行代理流量转发, 而后直接运行 BiocManager::install("TCGAbiolinks") , 选择所有包更新, 很顺利的就更新好了.
Sys.setenv(http_proxy="http://127.0.0.1:7890")
Sys.setenv(https_proxy="http://127.0.0.1:7890")
Sys.setenv(all_proxy="socks5://127.0.0.1:7890")
BiocManager::install("TCGAbiolinks")其中, 127.0.0.1 是本机(local_host)的ip地址, 而7890是Clash的默认端口.
安装成功后,就可以开始使用了。
如, 运行 TCGAbiolinks:::getGDCprojects()$project_id 获取各个癌种的项目id, 总计有74个.
library(TCGAbiolinks)
TCGAbiolinks:::getGDCprojects()$project_id
# [1] "GENIE-GRCC" "GENIE-DFCI" "GENIE-NKI" "GENIE-VICC"
# [5] "GENIE-UHN" "GENIE-MDA" "GENIE-MSK" "GENIE-JHU"
# ...
TCGAbiolinks:::getGDCprojects()$project_id %>% length()
# [1] 74如需获取TCGA癌症数据, 可以使用正则表达式获取开头带有 TCGA 的项目.
projects <- TCGAbiolinks::getGDCprojects()$project_id ## 获取癌症名字
projects <- projects[grepl("^TCGA", projects, perl = TRUE)]
projects
# [1] "TCGA-CHOL" "TCGA-LIHC" "TCGA-DLBC" "TCGA-BLCA" "TCGA-ACC" "TCGA-CESC" "TCGA-PCPG" "TCGA-PAAD" "TCGA-MESO" "TCGA-TGCT"
# [11] "TCGA-KIRP" "TCGA-UVM" "TCGA-UCS" "TCGA-THYM" "TCGA-COAD" "TCGA-ESCA" "TCGA-GBM" "TCGA-KICH" "TCGA-HNSC" "TCGA-PRAD"
# [21] "TCGA-OV" "TCGA-LUSC" "TCGA-LAML" "TCGA-LGG" "TCGA-SARC" "TCGA-BRCA" "TCGA-READ" "TCGA-LUAD" "TCGA-STAD" "TCGA-THCA"
# [31] "TCGA-KIRC" "TCGA-SKCM" "TCGA-UCEC"
projects %>% length
# [1] 33TCGA的33种癌症简写对应全称可在UCSC Xena查到.
查看一个项目内的可下载文件:
TCGAbiolinks:::getProjectSummary("TCGA-COAD")
# $file_count
# [1] 22585
# $data_categories
# file_count case_count data_category
# 1 4007 460 Copy Number Variation
# 2 2932 460 Sequencing Reads
# 3 6482 434 Simple Nucleotide Variation
# 4 1665 457 DNA Methylation
# 5 995 461 Clinical
# 6 1978 459 Transcriptome Profiling
# 7 2835 461 Biospecimen
# 8 363 360 Proteome Profiling
# 9 1328 289 Structural Variation
# $case_count
# [1] 461
# $file_size
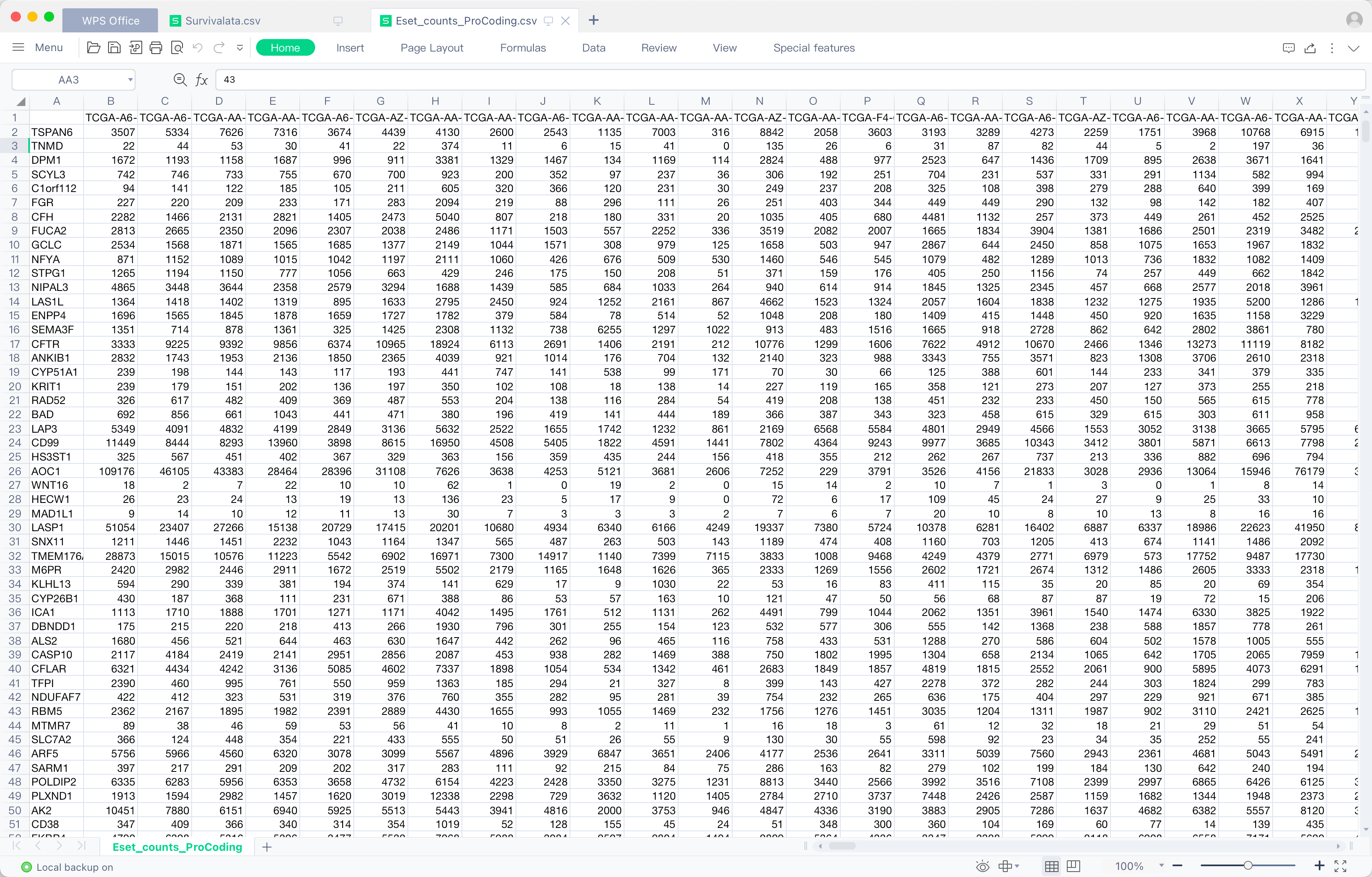
# [1] 7.004757e+13下载并提取mRNA的表达矩阵, 其中数据类别 data.category 是 Transcriptome Profiling 代表转录组数据; 数据类型 data.type 是 Gene Expression Quantification , 代表表达谱数据; 定量方式 workflow.type 是 STAR - Counts , 内含了 Counts / FPKM 和 FPKM-UQ 三种数据类型.
# 查询
query <- GDCquery(
project = project,
data.category = "Transcriptome Profiling",
data.type = "Gene Expression Quantification",
workflow.type = "STAR - Counts"
)
head(query$results[[1]], n=10) %>% View()
# 下载
GDCdownload(query, method = "api", files.per.chunk = 100) # 每次下载100个文件
# 整理
# GDCprepare(query, save = T, save.filename = paste0(project, "_mRNA.Rdata"))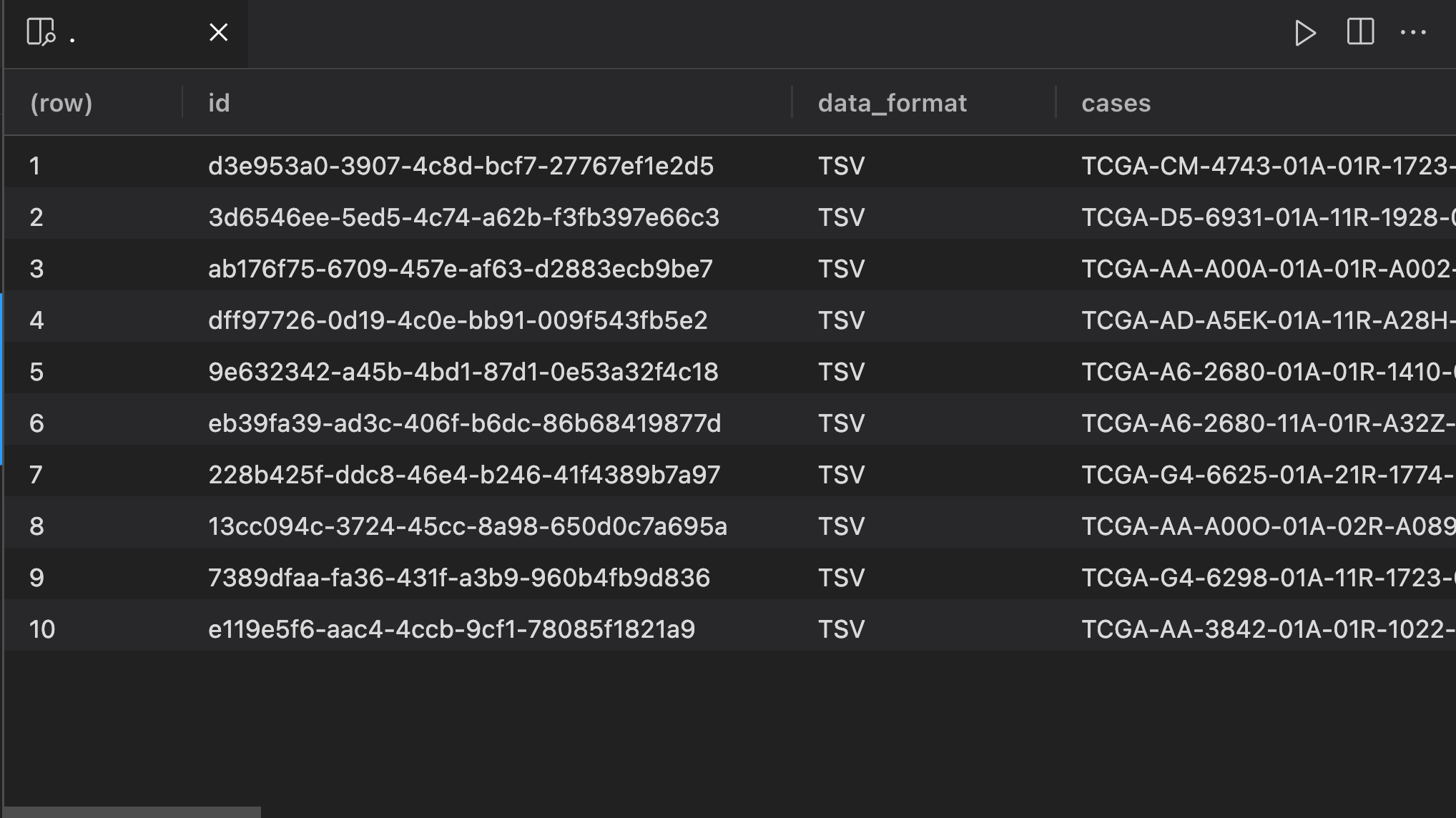
这里出现了一个意外... 我的硬盘提示空间不足了.. 在这个内存动不动64的年代, 我这个硬盘总共200g的可怜人实惨.. 可见 GDCprepare 函数需要强大的内存和硬盘空间, 我的本地电脑是做不到的, 因此继续使用老方案进行数据处理. 目前为止, 通过 TCGAbiolinks 进行数据下载的目的已经圆满达到.
首先保存 MANIFEST 文件以供后续分析:
shelfEnvironment(paste(imput_dir, "GDCdata", project, sep = "/"), path = root_dir)
write.csv(query$results[[1]], file = paste0(project, "_MANIFEST.csv"))shelfEnvironment 函数来源于 obgetDEGs 包, 可使用 devtools::install_github('sandy9707/obgetDEGs') 命令安装, 函数的作用是将目标文件夹设定为工作目录, 如果该目录不存在便创建. 详情可参考GitHub - sandy9707/obgetDEGs.
该函数的应用场景是:当需要在R中读取或写入数据时,需要指定存储数据的文件夹路径。但在执行R代码时,可能需要将当前工作目录更改为存储数据的文件夹路径。如果文件夹不存在,需要创建文件夹。这时, shelfEnvironment 函数可以帮助我们检查并创建文件夹,使得数据可以正常读取或写入。
表达谱数据处理
清空环境, 读取MANIFEST信息, 特别是需要样本名和文件夹名.
# !整理----
## 清除当前环境中的所有对象
rm(list = ls())
## 设置主文件夹路径, 并设置工作目录
(root_dir <- sub("/code.+", "", rstudioapi::getSourceEditorContext()$path))
source(paste(root_dir, "code", "prepare.R", sep = "/"))
project <- "TCGA-COAD"
shelfEnvironment(paste(imput_dir, "GDCdata", project, sep = "/"), path = root_dir)
json <- read.csv(paste0(project, "_MANIFEST.csv"))
# json[, c("cases", "file_id")]
case_names <- json[, "cases"]
filedir_in_json <- json[, "file_id"]选择提取部分
# 提取表达量至一个数据框(以tibble格式),counts值选4,fpkm选8,tpm选7
extract_type <- c("counts", "fpkm", "tpm")[1]
extract_num <- switch(extract_type,
"counts" = 4,
"fpkm" = 8,
"tpm" = 7
)开始提取, 原理是进入每一个文件夹并提取某列, 再结合基因类型, 并去重.
# 开始提取
matrix_MMRF_list <- list()
shelfEnvironment(paste(imput_dir, "GDCdata", project,
"/harmonized/Transcriptome_Profiling/Gene_Expression_Quantification",
sep = "/"
), path = root_dir)
for (i in 1:length(filedir_in_json)) {
setwd(paste0("./", filedir_in_json[i]))
matrix_MMRF_list[[i]] <- read.table(
file = list.files(pattern = ".tsv"),
header = F, fill = TRUE
)[, extract_num]
setwd("../")
}
setwd(paste0("./", filedir_in_json[i]))
probematrix <- read.table(list.files(pattern = ".tsv"),
header = F, fill = TRUE
)[, 2:3]
setwd("../")
matrix_MMRF <- do.call(cbind, matrix_MMRF_list)
matrix_MMRF <- cbind(probematrix, matrix_MMRF)
tibble_MMRF <- tibble::as_tibble(matrix_MMRF)
colnames(tibble_MMRF) <- c("gene_name", "gene_type", str_sub(case_names, 1, 16))
#
duplicated(colnames(tibble_MMRF), fromLast = TRUE) %>% table()
tibble_MMRF <- tibble_MMRF[, !duplicated(colnames(tibble_MMRF), fromLast = TRUE)]
duplicated(colnames(tibble_MMRF), fromLast = TRUE) %>% table()提取蛋白编码基因并将基因名保留转换行名.
# 提取蛋白编码基因
pcg <- c(
"protein_coding", "IG_V_gene", "IG_D_gene", "IG_J_gene",
"IG_C_gene", "TR_V_gene", "TR_D_gene", "TR_J_gene", "TR_C_gene"
)
# 创建一个tibble_MMRF对象,使用dplyr::filter()方法筛选出gene_type包含于pcg的所有行
mrna_exprset <- tibble_MMRF %>%
dplyr::filter(gene_type %in% pcg) %>%
# 使用dplyr::select()方法去掉gene_type列
dplyr::select(-gene_type) %>%
# 使用dplyr::distinct()方法去除重复的行,保留第一次出现的行
dplyr::distinct(gene_name, .keep_all = TRUE) %>%
# 使用tibble::column_to_rownames()方法将gene_name列转换为行名
tibble::column_to_rownames("gene_name")通过TCGA样本命名规则筛选需求样本并将对照组前置.
# 查看去掉01A和11A的样本个数, 通过数量可以看出效果一致
mrna_exprset %>%
select(-matches("[^(01)]A$|[^(11)]A$")) %>%
ncol()
mrna_exprset %>%
select(matches("[01]1[A]$")) %>%
ncol()
# 筛选, 只要01A和11A的样本
# 重新排序,将癌旁排在前面便于下一步筛选,0-9为癌数据,排在后面
mrna_exprset <- mrna_exprset %>%
select(matches("[01]1A$")) %>%
select(-matches(".-0[1-9][A]$"), everything())
ncol(mrna_exprset)写出表达矩阵, 特征列表和分组列表.
# 写出表达矩阵_extract_type
shelfEnvironment(paste(imput_dir, "GDCdata", project, sep = "/"),
path = root_dir
)
write.csv(mrna_exprset, paste0("Eset_", extract_type, "_ProCoding.csv"), row.names = T)
# 写出特征列表, 也就是基因名
write.table(rownames(mrna_exprset), "feature_list.csv",
row.names = FALSE, quote = FALSE, col.names = FALSE
)
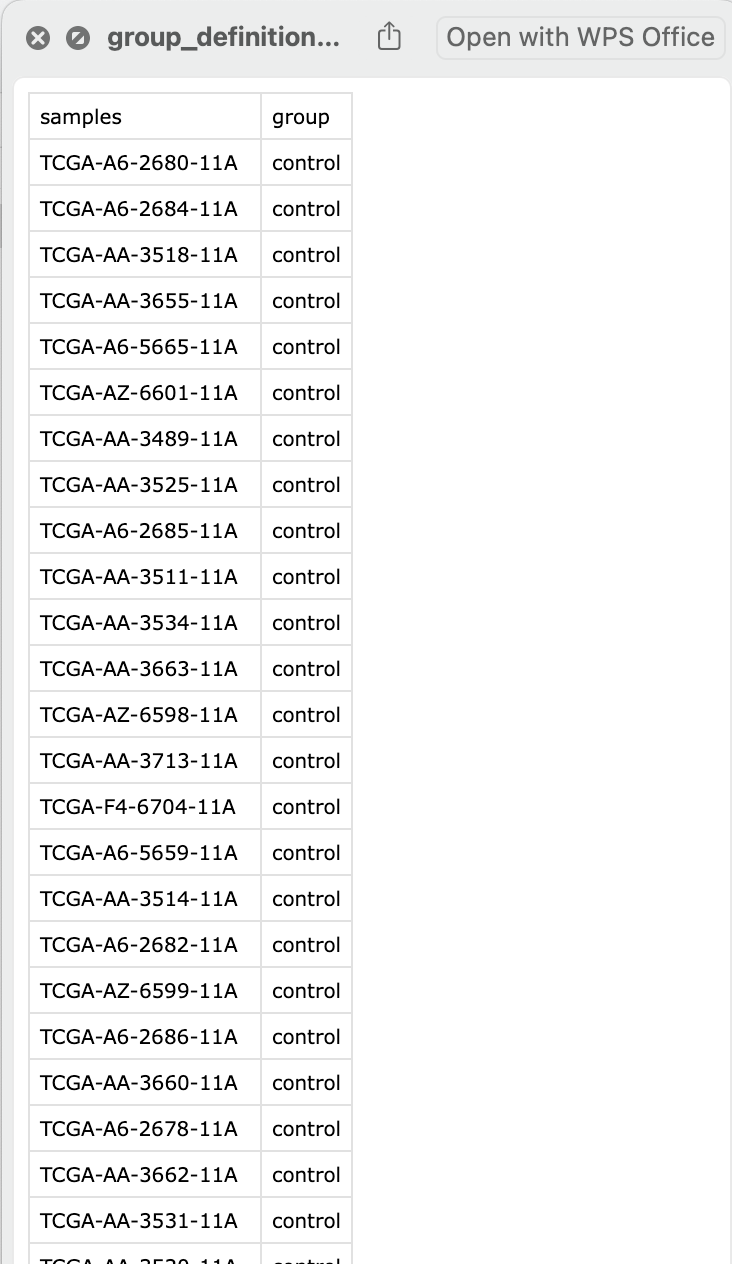
# 写出分组列表, 也就是组别
samples <- colnames(mrna_exprset)
group_definition_matrix <- data.frame(
samples,
group = ifelse(grepl("11A$", samples), "control", "test")
)
write.csv(group_definition_matrix,
file = "group_definition_matrix.csv", row.names = F
)sapply(projects, function(project){
query <- GDCquery(project = project,
data.category = "Clinical",
file.type = "xml")
GDCdownload(query)
clinical <- GDCprepare_clinic(query, clinical.info = "patient")
saveRDS(clinical,file = paste0(project,"_clinical.rds"))
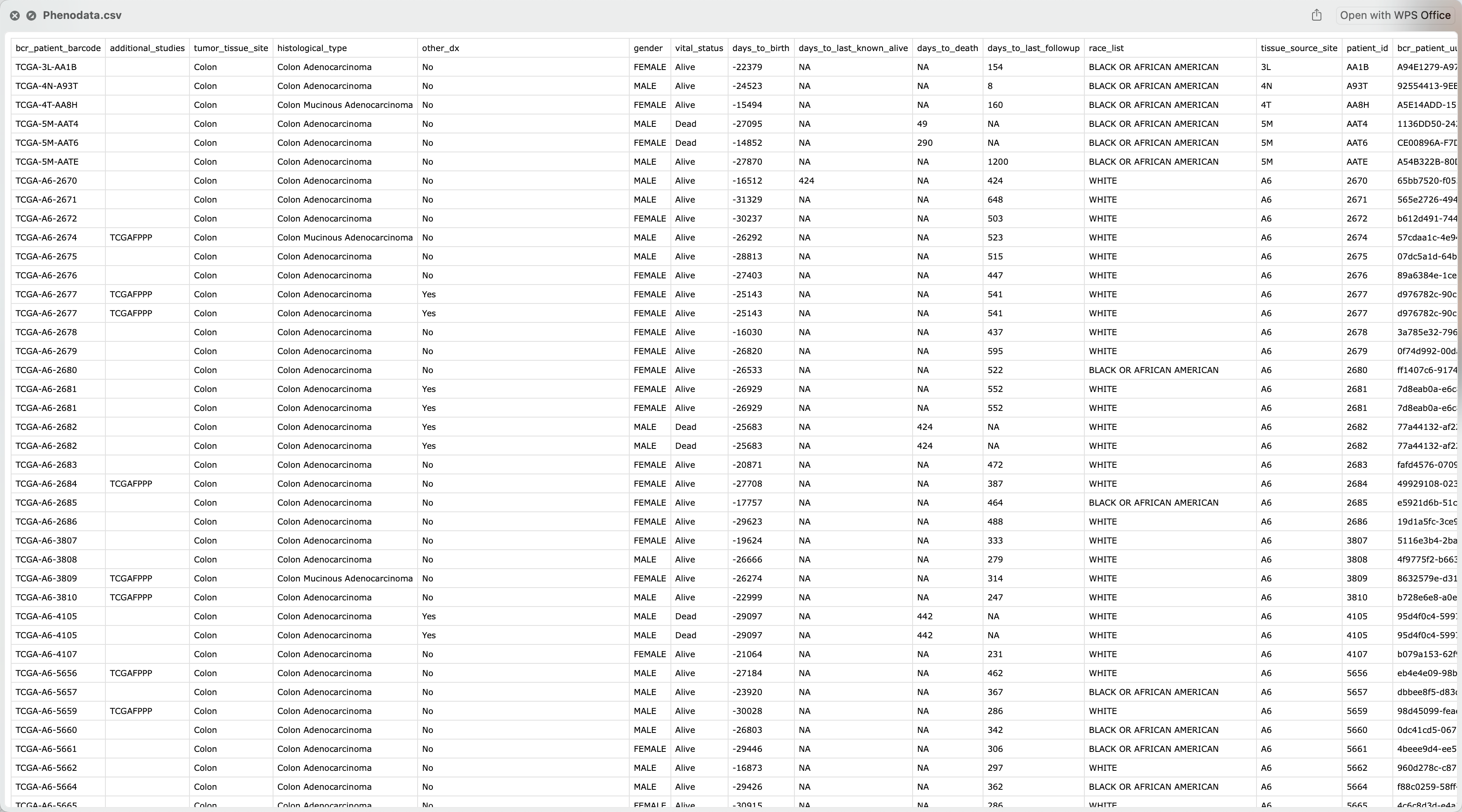
})临床数据下载及处理
# 临床数据
project
sapply(projects, function(project) {
query <- GDCquery(
project = project,
data.category = "Clinical",
file.type = "xml"
)
GDCdownload(query)
clinical <- GDCprepare_clinic(query, clinical.info = "patient")
# saveRDS(clinical, file = paste0(project, "_clinical.rds"))
})
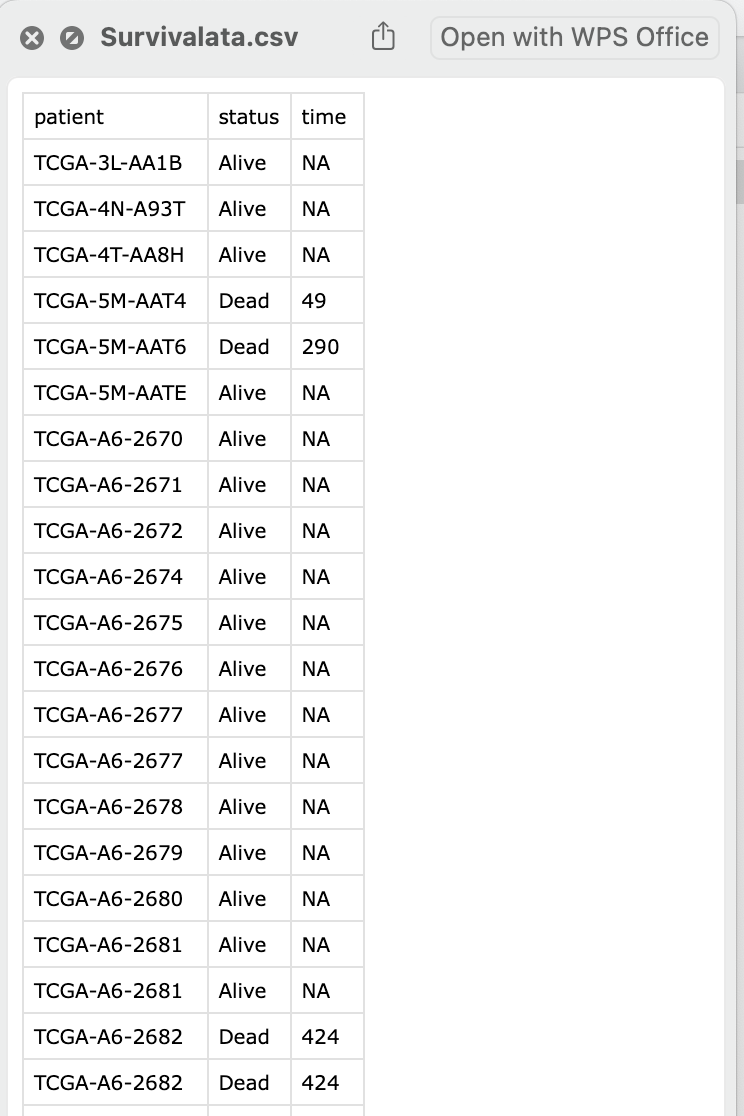
write.csv(clinical, paste0("Phenodata.csv"), row.names = F)
col_survivaldata <- setNames(
data.frame(clinical[, c("bcr_patient_barcode", "vital_status", "days_to_death")]),
c("patient", "status", "time")
)
write.csv(col_survivaldata, paste("Survivalata.csv", sep = "/"), row.names = F)引用
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。

