【免疫学实验】抗体标记与显微成像技术全解析
【免疫学实验】抗体标记与显微成像技术全解析
三兔测序学社
发布于 2025-12-29 12:56:51
发布于 2025-12-29 12:56:51
在免疫学研究中,抗体因其能稳定且特异性地结合抗原,常被用作识别细胞、组织或生物流体中特定分子的“探针”。
通过将抗体与不同的标记物结合,我们可以在单个细胞或组织切片中准确定位靶分子。今天,我们就来详细解读几种基于抗体的显微成像技术。
🌈 一、 免疫荧光显微成像
利用荧光染料(荧光色素或荧光团)标记抗体本身,或用于检测抗体的抗免疫球蛋白抗体,再用显微镜检测,这种技术称为免疫荧光显微成像。
1. 样本处理的优势
由于抗蛋白质抗体可以识别天然折叠蛋白质的表面特征,因此在抗原-抗体反应完成后,我们可以使用温和的化学固定技术或冷冻组织切片,以最大程度地保存目的蛋白的天然结构。
当然,也有部分抗体可以结合变性蛋白质,从而用于固定组织切片的检测。
2. 标记方法
直接法: 荧光染料直接共价结合到特异性抗体上。
间接法: 先使用未标记的一抗结合抗原,再利用荧光标记的二抗(抗免疫球蛋白)进行检测。
3. 常用荧光染料荧光染料被特定波长的光(通常是蓝光或绿光)激发后,会发出不同波长的可见光。最常用的包括:
发出绿光: 荧光黄
发出红光: 德州红、多甲藻素-叶绿素-蛋白质复合物(PerCP)
发出橙色/红色光: 罗丹明、藻红蛋白(PE)
通过将不同染料附着到不同抗体上,我们可以在同一细胞或组织切片中,同时确定两种或多种分子的分布。
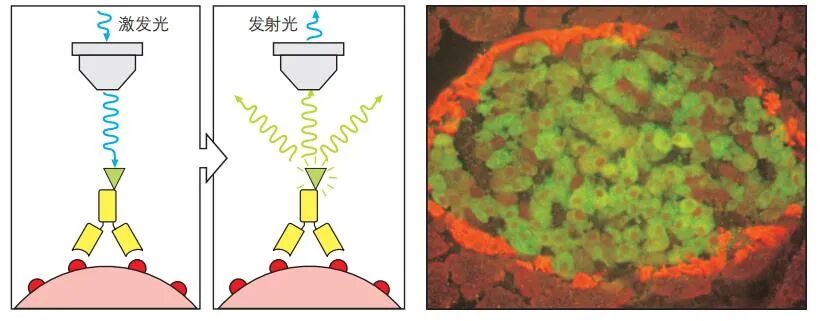
免疫荧光显微镜:利用不同荧光染料标记的特异性抗体对组织切片进行免疫荧光染色,可实现多靶点定位。图中显示胰岛组织:绿色荧光标记的抗谷氨酸脱羧酶(GAD)抗体特异性染色分泌胰岛素的β细胞;橙色荧光标记的抗胰高血糖素抗体则染色α细胞。该技术常用于研究I型糖尿病中,针对β细胞(GAD为重要自身抗原)的自身免疫破坏过程。
🖥️ 二、 进阶成像:共聚焦与双光子显微镜
为了获得更高的分辨率或观察更深的组织层次,科学家们发展出了共聚焦显微镜和双光子显微镜。
1. 激光扫描共聚焦显微镜
原理: 采用计算机辅助技术,利用激光聚焦在样品特定断层平面。发射光通过“针孔”重新聚焦,确保只有来自所需平面的光到达检测器,从而屏蔽离焦光线。
优势: 提供亚微米级的高分辨率,图像比传统荧光显微镜更清晰,并能建立三维图像。
应用: 可用于研究固定细胞或表达荧光蛋白(如GFP、RFP等)的活细胞。例如,可视化研究T细胞接触时的TCR、CD45等分子分布。
2. 双光子扫描荧光显微镜
原理: 采用波长更长的超短脉冲激光,使两个低能量光子几乎同时激发荧光基团。这种激发仅发生在焦点处。
优势:
穿透更深: 可达几百微米(共聚焦仅约80μm)。
光损伤小: 近红外光对活组织损害小,不易引起荧光淬灭。
背景低: 散射的单光子不会激发荧光,信噪比高。
应用: 适合长时间的活体动态追踪。
🎥 三、 动态追踪:延时视频成像
为了跟踪分子或细胞随时间的运动,我们可以结合使用敏感的数码相机和感光材料的延时视频成像来辅助共聚焦或双光子显微镜技术。
在免疫学中,延时双光子荧光成像具有特别重要的意义。它可以在完整淋巴器官和淋巴组织中,实时跟踪荧光蛋白标记的T细胞和B细胞,以及它们相互作用的具体位置。
🧲 四、 免疫电子显微镜
当光学显微镜的分辨率无法满足需求时,我们需要借助电子显微镜。
原理: 以金颗粒标记抗体,对超薄切片进行染色,然后在透射电镜中以高分辨率检测细胞内特定位置的结构或蛋白质。
多重标记: 通过标记不同直径的金颗粒,可以同时检测两种或以上的蛋白质。
难点: 由于每个超薄切片中只存在少量的抗原分子,因此如何对切片进行充分的染色是该技术的主要难点。
总结
从基础的免疫荧光到高分辨率的共聚焦,再到活体深层成像的双光子以及超微结构的免疫电镜,抗体作为探针,为我们揭示了生命科学微观世界的无穷奥秘。
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2025-12-16,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读

