Nat. Rev. Drug Discovery | 2025年美国FDA新药审批回顾:46项新药获批,肿瘤领域持续领跑
Nat. Rev. Drug Discovery | 2025年美国FDA新药审批回顾:46项新药获批,肿瘤领域持续领跑

DrugIntel
发布于 2026-01-06 14:29:27
发布于 2026-01-06 14:29:27
作者:Asher Mullard(原载《Nat. Rev. Drug Discovery》 2026年)
尽管监管机构经历了动荡的一年,美国FDA在2025年共批准了46种新药。 药物开发商从FDA的药物评价与研究中心(CDER) 获得了46种新治疗药物的批准。这一数量使近5年的年均新药批准数略微下降至48种(图1)。但目前的批准数量仍远高于1993年以来的历史平均水平(年均36种新药)。
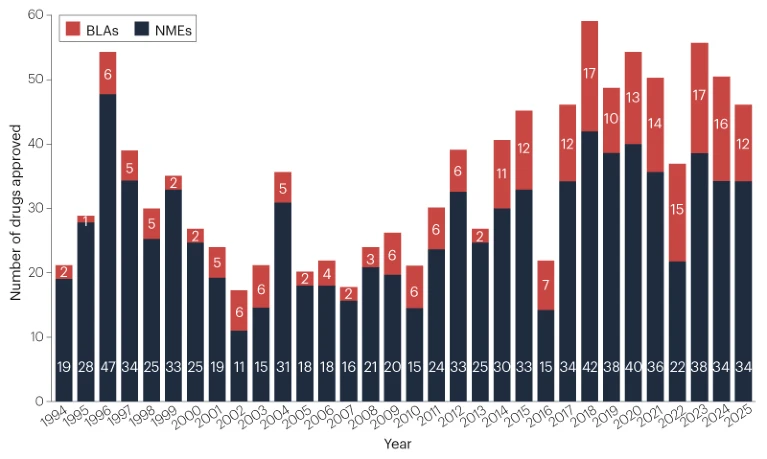
图1 | 1993年以来FDA的新药获批情况。 由美国FDA药品审评与研究中心(CDER)批准的新分子实体(NME) 和生物制品许可申请(BLA) 的年度数量。2025年的新批产品参见原文表1或下图。生物制品审评与研究中心(CBER) 批准的产品(包括疫苗和基因疗法)不纳入此药物计数(参见表2)。来源:FDA。

图片来自 Chris De Savi
癌症仍是新药批准中最常见的治疗领域(图2)。CDER批准的新药中,有16种(35%)针对癌症,高于过去5年29%的平均水平。其他活跃领域包括心脏病(5项新批准,占11%)以及过敏和炎症性疾病(4项新批准,占9%)。
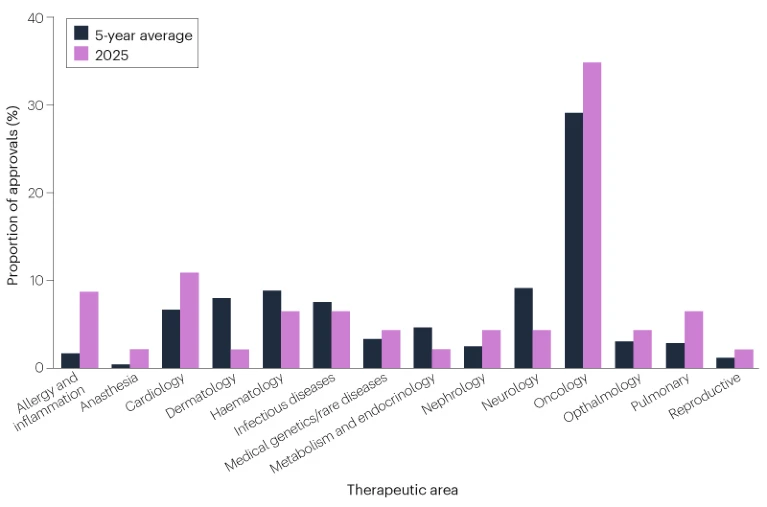
图2 | CDER批准药物的治疗领域分布。 对于横跨多个疾病领域的适应症,仅根据负责审评申请的FDA办公室和部门归类于一个领域。
药物开发商持续推动多种创新疗法进展,包括首款基于adnectin(一种工程蛋白支架)的生物疗法(图3)。
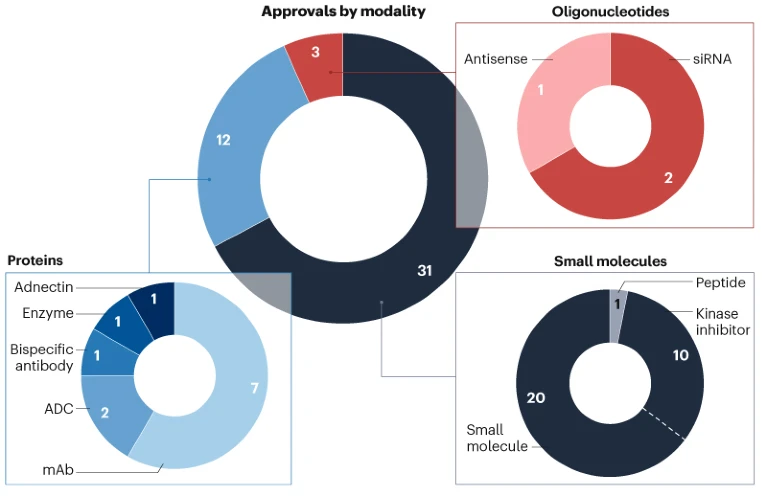
图3 | CDER批准药物的药物形态分布。 小分子药物(包括长度不超过40个氨基酸的肽段)和寡核苷酸作为新分子实体(NME) 获批。基于蛋白质的候选药物则通过生物制品许可申请(BLA) 获批。ADC,抗体偶联药物;mAb,单克隆抗体;siRNA,小干扰RNA。
2025年也是激酶抑制剂有史以来成果最丰硕的一年,约占新批准小分子药物的三分之一。诺华的remibrutinib(Rhapsido) 成为FDA批准的第100个激酶抑制剂,彰显了此类药物在肿瘤领域之外的持续扩展。邓迪大学的Philip Cohen向《Nature Reviews Drug Discovery》表示:“这一领域尚未枯竭。”
FDA尚未按监管分类公布这些新批准的细分数据。 生物制品评价与研究中心(CBER) 批准了8款值得关注的新产品(表2),包括首款由非营利组织开发的基因疗法。
波士顿咨询集团的一项即将发布的分析显示,CDER和CBER新批准药物的平均峰值销售额约为12亿美元,中位数约为6亿美元。
然而,2025年对FDA来说是动荡的一年,自特朗普总统任命小罗伯特·F·肯尼迪领导美国卫生与公众服务部以来,人员配置和政策发生了剧烈变化。在今年前9个月,FDA的CDER和CBER超过18%的员工被解雇或辞职。CDER在一年内更换了五位主任。
尽管如此,FDA仍推出了新的审批计划和途径。它启动了FDA局长国家优先审评券(CNPV)试点计划,旨在将审评时间从通常的10-12个月缩短至2个月。一些FDA工作人员和监督机构警告,这一有争议的计划可能使药物审评过程政治化并侵蚀监管标准。FDA还针对随机试验不可行的情况(包括定制化的个体化(n-of-1)疗法)提出了合理机制途径,并宣布了逐步取消动物毒性测试的计划。
未来可能有更多变化。FDA通常要求药物开发商进行两项关键试验才能获得产品的完全批准,但据报道,FDA正倾向于将默认要求改为一项试验。
肿瘤药物领域
癌症继续主导着行业的研发管线。虽然肿瘤药物贡献了大部分新批准,但根据Evaluate的预测,其中只有两款药物的年收入潜力超过20亿美元,成为潜在的超重磅药物。
最畅销的新批准药物可能是默克的帕博利珠单抗(pembrolizumab)皮下制剂联合berahyaluronidase alfa(Keytruda Qlex),用于多种实体瘤。帕博利珠单抗是一种里程碑式的PD-1抑制剂,最早于2014年获批,能解除对免疫细胞的抑制,攻击癌细胞。Berahyaluronidase alfa是一种内切糖苷酶,有助于抗体注射,通过暂时分解皮下细胞外基质来改善抗体的渗透和吸收。几十年来,药物开发商一直使用透明质酸酶作为扩散剂,但这是这种工程化蛋白质变体首次获得批准。因此,默克的这种组合被视为一项新药批准。
帕博利珠单抗预计在2025年带来约320亿美元的收入,使其成为最畅销的癌症药物(总销售额排名第三)。Evaluate的分析师预计皮下制剂产品的峰值销售额将达到93亿美元。
康方生物(Akeso Biopharma) 其PD-1抑制剂penpulimab获得批准,使得可用的PD-1/PD-L1抗体数量增至12个。
2025年还批准了两种新的抗体偶联药物(ADC),这是一种由组织选择性抗体与强效细胞杀伤药物融合组成的疗法。第一三共的TROP2靶向ADC datopotamab deruxtecan(Datroway) 获得批准,用于治疗接受过内分泌治疗和化疗的激素受体阳性、HER2阴性乳腺癌。Evaluate预测该ADC的峰值销售额可达54亿美元,前提是可能在一个更大的非小细胞肺癌(NSCLC)群体中获得额外批准。吉利德和Immunomedics的首创TROP2靶向ADC sacituzumab govitecan(Trodelvy) 最早于2020年获得加速批准,预计在2025年将获得14亿美元的收入。
FDA还批准了艾伯维的首创c-Met靶向ADC elisotuzumab vedotin(Emrelis)。这种搭载微管抑制剂的抗体被批准用于治疗具有高c-Met蛋白过度表达的非鳞状非小细胞肺癌。
再生元的linvoseltamab(Lynozyfic) 为双特异性T细胞衔接器家族增添了新成员。Linvoseltamab可结合B细胞上的BCMA和T细胞上的CD3,以驱动B细胞耗竭,用于治疗多发性骨髓瘤。它是第三个上市的BCMA × CD3双特异性抗体,也是第十个双特异性T细胞衔接器。
在激酶抑制剂方面,FDA罕见地批准了两种先前均为实验性药物的全新组合疗法。Verastem的avutometinib联合defactinib(Avmapki Fakzynja Co-Pack) 将MEK抑制剂和FAK抑制剂结合,用于治疗KRAS突变的复发性低级别浆液性卵巢癌。Defactinib是首个获得批准的FAK抑制剂。FDA已批准其他几种MEK抑制剂。FDA将这两种新型激酶抑制剂计为一项新药批准。Verastem的首席科学官Jonathon Pachter向《Nat. Rev. Drug Discovery》表示:“更多人应该对全新的组合疗法持开放态度。”
爵士制药公司的首创线粒体酪蛋白水解蛋白酶P(ClpP)激活剂dordaviprone(Modeyso) 获得加速批准,用于治疗携带H3 K27M突变、既往治疗后疾病进展的弥漫性中线胶质瘤患者。ClpP会降解线粒体蛋白,其激活被假设可诱导整合应激反应、细胞凋亡和代谢物释放,从而逆转H3 K27M突变的增殖效应。
首创疗法与巨大未满足需求
CDER批准的非肿瘤药物中,也有两款具有首创机制、针对新疾病适应症的潜在超重磅药物。
Insmed的brensocatib(Brinsupri) 是首个上市的DPP1抑制剂,用于治疗支气管扩张,展示了靶向中性粒细胞药物在炎症性肺病中的潜力。支气管扩张是一种慢性肺部疾病,导致过度黏液产生、持续咳嗽和气道扩张。在美国,它影响35万至50万人,此前唯一的治疗选择是促进黏液清除的物理疗法和解决相关呼吸道感染的抗生素。该疾病与中性粒细胞(一种先天免疫细胞)过度活跃有关。DPP1抑制剂brensocatib可抑制中性粒细胞丝氨酸蛋白酶(NSPs)的产生,使这些炎症蛋白酶失活,同时保留中性粒细胞的其他效应功能。参与brensocatib临床试验的纽约大学朗格健康中心的肺科医生Doreen Addrizzo-Harris向《Nat. Rev. Drug Discovery》表示:“这是一个充满希望的时刻——能够告诉患者,即将出现可能真正帮助他们的新药。”分析师预测该药的峰值销售额可达63亿美元,前提是在其他中性粒细胞介导的疾病中获得进一步批准。然而,在12月,该公司因该药未能减少慢性鼻窦炎中的鼻腔炎症而终止了在该适应症的开发。
福泰制药的NaV1.8钠通道抑制剂suzetrigine(Journavx) 为急性疼痛提供了亟需的非阿片类镇痛药选择。自2000年代研究人员发现人类NaV1.7通道的功能获得性突变可导致持续性疼痛问题,而功能丧失性突变可阻止疼痛感知以来,药物开发商一直致力于抑制NaV钠通道。NaV1.7抑制剂在临床中令人失望,但福泰制药坚持研究相关的NaV1.8通道。福泰制药研究高级副总裁Paul Negulescu向《Nat. Rev. Drug Discovery》表示:“这是首款专门设计用于仅影响疼痛的药物。Suzetrigine是开端,但并非终点。是这类新药迈出的重要第一步。”分析师考虑到对非成瘾性镇痛药的需求及其在慢性疼痛适应症中的更广泛机会,预测该药的峰值销售额为37亿美元。但也面临阻力。Suzetrigine的批准是基于其在某些外科手术后的急性疼痛中不劣于对乙酰氨基酚-阿片类药物组合,但其在其他急性疼痛情况下的可比性尚不清楚。它的价格也远高于已有数十年历史且已有仿制药的旧药。该药对慢性疼痛的疗效仍有待观察。suzetrigine用于疼痛性糖尿病周围神经病变的III期研发正在进行中,但在一项腰骶神经根病试验中失败。福泰制药在年底终止了其后续NaV1.8抑制剂VX-993在急性疼痛中的开发,因该药在II期试验中未达到主要终点。
其他首创药物也为药物工具箱增添了重要内容,但销售额预期较低。例如,葛兰素史克的gepotidacin(Blujepa) 提供了亟需的新型口服抗生素选择。gepotidacin与自1960年代开始使用的喹诺酮类抗生素一样,可抑制细菌IIA型拓扑异构酶。但它使用了不同的骨架并以不同的位点结合靶点,因此获得了首创抗生素的称号。FDA于5月首次批准其用于治疗成人和12岁及以上儿科患者的单纯性尿路感染(uUTIs)。12月,FDA批准其用于治疗淋病。
Innoviva Specialty Therapeutics的zoliflodacin(Nozolvence) 是另一种结构独特的细菌II型拓扑异构酶抑制剂,也获得了FDA批准用于治疗淋病。zoliflodacin的III期试验由公共资助的非营利组织“全球抗生素研发伙伴关系(GARDP)”资助和执行,该组织计划在全球范围内提供和普及这种药物。Innoviva通过收购阿斯利康的衍生公司Entasis Therapeutics获得了该药。
成熟靶点,新适应症
激酶抑制剂在作用于BTK的药物引领下,继续向炎症和免疫疾病领域推进。BTK抑制剂最初基于其杀死恶性B细胞的能力被批准用于治疗血癌,但它们也可用于调节这些免疫细胞的活性。今年,赛诺菲的rilzabrutinib(Wayrilz) 首次获批用于治疗免疫性血小板减少症(一种自身免疫性血液疾病)。诺华的remibrutinib(Rhapsido) 获得批准用于治疗慢性自发性荨麻疹。分析师预测remibrutinib的峰值销售额为21亿美元,该药仍在进行多发性硬化、重症肌无力、化脓性汗腺炎和食物过敏的临床开发。他们预计赛诺菲的rilzabrutinib的峰值销售额为9亿美元。相比之下,FDA拒绝了赛诺菲的BTK抑制剂tolebrutinib用于治疗多发性硬化。
勃林格殷格翰的nerandomilast(Jascayd) 成为首个用于治疗特发性肺纤维化(IPF)的PDE4抑制剂。抗炎和免疫调节PDE4抑制剂已获批用于其他适应症,包括慢性阻塞性肺病和银屑病。勃林格殷格翰现新增IPF适应症,这是一种慢性致命性肺部疾病,全球影响高达360万人。nerandomilast优先抑制PDE4B家族成员,以抑制肺部的促纤维化过程和炎症。这是10多年来首个上市的治疗IPF的新药,继2014年FDA批准勃林格殷格翰的多激酶抑制剂尼达尼布(Ofev)和抗纤维化吡非尼酮(Esbriet,现由Legacy Pharma销售)之后。
新形态
LIB Therapeutics的PCSK9抑制剂lerodalcibep(Lerochol) 获得了基于adnectin的疗法的首次批准。Adnectins是使用纤连蛋白III型结构域构建的生物制剂,这些支架蛋白可促进细胞间相互作用并能结合各种配体。几十年来,研究人员一直认为adnectins可以作为抗体模拟物,为细胞外和细胞表面靶点提供极高的选择性,同时比传统单克隆抗体结构更小、更简单、更稳定。LIB采用该技术开发了最新的PCSK9阻滞剂,这是一个经过充分验证的降脂靶点。PCSK9靶向抗体上市已有10年。这些药物的使用尚未达到一度高涨的期望,部分原因是抗体的成本以及与通用降脂药片相比皮下给药的不便。LIB希望其lerodalcibep——一种可自行给药、每月一次皮下注射且具有延长室温稳定性的药物——将具有便利性优势。然而,口服小分子PCSK9抑制剂可能即将问世。默克公司预计将在4月为其每日一次给药的enlicitide提交FDA申请。FDA已授予该药CNPV,因此可能会进行快速审评。如果获批,该公司表示计划使其“作为美国患者负担得起的选择而广泛可用”。
疾病领域聚焦:遗传性血管性水肿(HAE)
HAE患者获得了三种新药。HAE是一种罕见的遗传性肿胀疾病,由调节多种丝氨酸蛋白酶活性的C1酯酶抑制剂缺乏或功能障碍引起。C1抑制剂缺乏导致补体蛋白酶、血浆激肽释放酶以及凝血蛋白酶因子XIa、XIIa和XIIf的活性增加。
CSL Behring新获批的预防性抗体garadacimab(Andembry) 靶向活化的XII因子以预防疾病发作。Ionis的反义寡核苷酸donidalorsen(Dawnzera) 靶向激肽释放酶原,同样用于预防疾病发作。相比之下,Kalvista的小分子血浆激肽释放酶抑制剂sebetralstat(Ekterly) 被批准用于治疗急性发作。然而,这些新药进入了一个拥挤的HAE市场,并与作用于病理通路不同节点的已确立的预防和急性治疗方案竞争。
有疾病进展风险的原发性免疫球蛋白A肾病(IgAN) 患者获得了两种新疗法。IgAN是一种免疫介导的肾脏疾病,其中含有免疫球蛋白A(IgA)的免疫复合物在肾脏中积聚。它会导致肾功能进行性丧失,并可能导致肾衰竭。大冢制药的sibeprenlimab(Voyxact) 是该疾病的首创APRIL靶向抗体,可抑制IgA产生以减少患者的蛋白尿。诺华新批准的atrasentan(Vanrafia) 是一种内皮素受体拮抗剂,可降低肾脏中的肾小球压力和炎症。Vera Therapeutic的atacicept(一种抑制BLyS和APRIL的融合蛋白)也正在接受FDA对IgAN的审评,决定将于2026年做出。
非营利性基因疗法
CBER继续增加基因疗法的批准。这包括首款由非营利组织获得的批准:Fondazione Telethon ETS的etuvetidigene autotemcel(Waskyra) 获批用于治疗Wiskott-Aldrich综合征(WAS)。WAS是一种罕见的遗传性疾病,由WAS基因突变导致血小板形成异常引起。Etuvetidigene autotemcel是一种离体基因疗法,使用慢病毒载体将WAS基因序列添加到患者来源的造血干细胞中,恢复血小板功能。该基因疗法源于2010年非营利组织Fondazione Telethon、San Raffaele Telethon基因治疗研究所和葛兰素史克之间的合作,并已显示出持久的疗效。当葛兰素史克在基因疗法的商业化方面遇到困难时,它将实验性的etuvetidigene autotemcel授权给了Orchard Therapeutics。Orchard于2022年将其授权给了Fondazione Telethon。Fondazione Telethon将与一家非营利生物技术公司Orphan Therapeutics Accelerator合作,为美国患者提供该基因疗法。合作伙伴预计每年在美国用该基因疗法治疗的患者不到10名。定价谈判正在进行中。基因治疗界正密切关注非营利模式将如何运作。San Raffaele Telethon基因治疗研究所临床研究副主任Alessandro Aiuti向期刊表示:“作为一名学术科学家,我想说我低估了申请上市和维持药物在市场上的负担。”Aiuti帮助促成了该基因疗法的获批。
FDA还批准了Abeona Therapeutics的prademagene zamikeracel(Zevaskyn),这是首款基于细胞片的基因疗法,用于治疗一种严重皮肤病。Prademagene zamikeracel由从患者身上活检的皮肤细胞制成,经离体转导携带编码VII型胶原的基因,然后生长成信用卡大小的细胞片,移植到伤口上。它被批准用于治疗隐性营养不良性大疱性表皮松解症(DEB),这是一种由编码VII型胶原的基因突变引起的罕见遗传性皮肤病。该疾病患者的皮肤脆弱,容易撕裂和起水疱。FDA在2023年批准了Krystal Biotech的beremagene geperpavec(Vyjuvek),这是一种局部、可重复给药的VII型胶原基因疗法,可加速DEB患者的伤口愈合。
Precigen的zopapogene imadenovec(Papzimeos) 是首款用于一种称为复发性呼吸道乳头状瘤病(RRP)的罕见病毒性疾病的免疫疗法。RRP由人乳头瘤病毒(HPV)感染引起,导致气道中出现非癌性增生。Zopapogene imadenovec由一种非复制型 gorilla 腺病毒载体组成,载有HPV 6和11的基因,可触发针对HPV的T细胞反应以清除这些增生。
CBER还完全批准了两种新的COVID-19疫苗。Moderna的mNexspike是一种下一代mRNA疫苗,每剂使用的mRNA量是该公司早期Spikevax的五分之一,并且仅编码刺突蛋白的部分片段。分析师预测该疫苗的销售额将超过32亿美元。
拒绝信透明度
在FDA的另一项政策变化中,该机构开始公布被拒药物的部分编辑版的完整回复信。截至12月31日,它列出了2025年被拒的43项申请,包括提交给CDER或CBER的新药(表3)、补充申请、仿制药和生物类似药。
Scholar Rock因其抗前肌肉生长抑制素抗体apitegromab收到了完整回复信。Scholar Rock开发了这种增肌抗体用于脊髓性肌萎缩症,但FDA因第三方灌装工厂的问题拒绝了它。Scholar Rock计划在制造问题解决后重新提交该药。
再生元因其CD20 × CD3靶向双特异性抗体odronextamab(用于滤泡性淋巴瘤)收到了第二封完整回复信。这次拒绝部分原因也出在同一家灌装工厂的问题。
Stealth Bio因其线粒体心磷脂结合剂elampretide(用于治疗Barth综合征)在5月收到了完整回复信。FDA当时表示,提交的资料未能显示出足够有效性的证据以支持完全或加速批准。几个月后,Stealth提交了新的资料,基于不同的替代终点寻求批准,并于9月获得了批准。
FDA还拒绝了Replimune的vusolimogene oderparepvec,该药本可能成为自2015年安进的talimogene laherparepvec(Imlygic)获批以来首个上市的溶瘤病毒。一项vusolimogene oderparepvec联合PD-1阻滞剂nivolumab治疗黑色素瘤患者的试验显示,缓解率在数值上高于历史对照率,但FDA的完整回复信指出,该试验中患者群体的异质性妨碍了对这些结果的解读。该试验也无法将治疗病毒的效果与PD-1阻滞剂的效果分离开来。Replimune此后重新提交了vusolimogene oderparepvec的上市申请。决定预计在4月做出。
展望新年
多款新药可能在2026年获得首次批准(表4)。
Arvinas和辉瑞的雌激素受体(ER)靶向药物vepdegestrant可能成为首个获得FDA批准的靶向蛋白降解剂。FDA已批准了几种选择性雌激素受体降解剂(SERDs),它们诱导ER构象变化以驱动降解。Vepdegestrant是一种双臂小分子PROTAC,用一臂结合受体,另一臂结合蛋白酶体机制的一部分以诱导降解。然而,该药在试验中难以与已批准和实验中的SERDs区分开来,Arvinas和辉瑞正寻求对外授权这款首创机制的药物。如果获批,vepdegestrant仍将验证靶向降解剂这一模式。药物开发商期望该模式及相关分子胶降解剂可能解锁其他不可成药的靶点。
Denali Therapeutics预计其酶替代疗法tividenofusp alfa将获批用于治疗亨特综合征。武田的idursulfase(Elaprise)(一种艾杜糖醛酸-2-硫酸酯酶(IDS)酶替代疗法)自2006年起获批用于该病,但入脑效果差,无法解决与该病相关的神经系统症状。Tividenofusp alfa由IDS蛋白与一个结合转铁蛋白受体的Fc片段融合而成,可将生物制剂转运至中枢神经系统。
Regenxbio的clemidsogene lanparvovec也可能获得批准,这是一种注射到中枢神经系统用于治疗亨特综合征的基因疗法。
来源:https://www.nature.com/articles/d41573-026-00001-z
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2026-01-03,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读
目录

