Nature medicine:基于可穿戴运动追踪数据早期识别帕金森疾病
原创Nature medicine:基于可穿戴运动追踪数据早期识别帕金森疾病
原创
摘要:帕金森病是一种具有长期潜伏期的神经退行性运动障碍,目前尚无治疗方法。可靠的预测性生物标志物可能会改变开发神经保护治疗的努力,但仍有待确定。利用UK Biobank,我们研究了加速度计在普通人群中识别前驱帕金森病的预测价值,并将这种数字生物标志物与基于遗传、生活方式、血液生化或前驱症状数据的模型进行了比较。使用加速度计数据训练的机器学习模型在区分临床诊断的帕金森病和诊断前7年的前驱帕金森病与普通人群方面的测试性能优于所有其他测试模。加速度计是一种潜在的重要、低成本的筛查工具,用于确定有患帕金森病风险的人,并确定神经保护治疗临床试验的参与者。
1. 引言
对于大多数被诊断为帕金森病(PD)的患者来说,50%-70%的黑质多巴胺能神经元在标志性运动症状出现并做出临床诊断时已经退化。因此,仍然需要确定廉价、可靠、易于获取和敏感的生物标志物来检测早期病理变化,在这一领域的成功可能会在确定神经保护疗法临床试验的合适参与者方面具有变革性。众所周知,在临床诊断时,多种前驱症状可能已经存在数年,包括快速眼动睡眠行为障碍(RBD),便秘、低体温、抑郁、焦虑和白天嗜睡,伴有尿功能障碍、体位性低血压、阈下运动症状和多巴胺能分子脑成像异常最近被添加到前驱PD的标准中。先前的多项研究已经检测了这些和其他标记物,以确定它们在识别前驱PD中的敏感性。然而,结合多个数据源的预测能力的多模态模型的缺乏限制了这项工作。此外,大多数研究倾向于将前驱PD患者与没有任何合并症的对照组进行比较,这限制了这些研究结果的转化有效性和现实适用性。更多的研究
数字传感器可以在不增加成本或努力的情况下,在现实环境中被动地持续收集数据,从而获得对一个人的缺陷和能力的可靠估计,并尽早发现细微的变化。由于时间、费用、可及性和敏感性的限制,这种监测不能通过临床评估来实现”。对数字传感器收集的加速和心率数据的初步分析表明,该设备具有区分临床诊断为PD的患者和非PD患者的潜力,并具有监测运动进展和描述睡眠行为的附加功能。然而,这些定量运动测量在很大程度上仍未得到充分研究,研究往往受到小样本量的限制,或者仅限于临床PD诊断后的分析。在临床诊断之前,利用数字传感器检测早期运动改变和识别疾病是一个很大程度上未开发的领域,在普通人群中有很大的应用潜力。本研究使用了英国生物银行(UKBB)招募的大型前瞻性人群队列。自2006年以来,收集了超过50万名年龄在40-69岁之间的个体的数据,并对临床状况进行了持续的被动随访。通过电子邮件联系随机选择的该队列的一个子集(n=103,712,收集于2013-2015年)收集加速度计数据。利用这些数据,我们试图确定加速度计数据是否可以作为PD的前驱标志物,通过将PD诊断或已经诊断为PD的人与匹配和不匹配的未受影响的对照组以及诊断为相关疾病(即神经退行性疾病)的个体的数据进行比较,来检查其特异性。运动障碍和共病临床障碍(图1)。
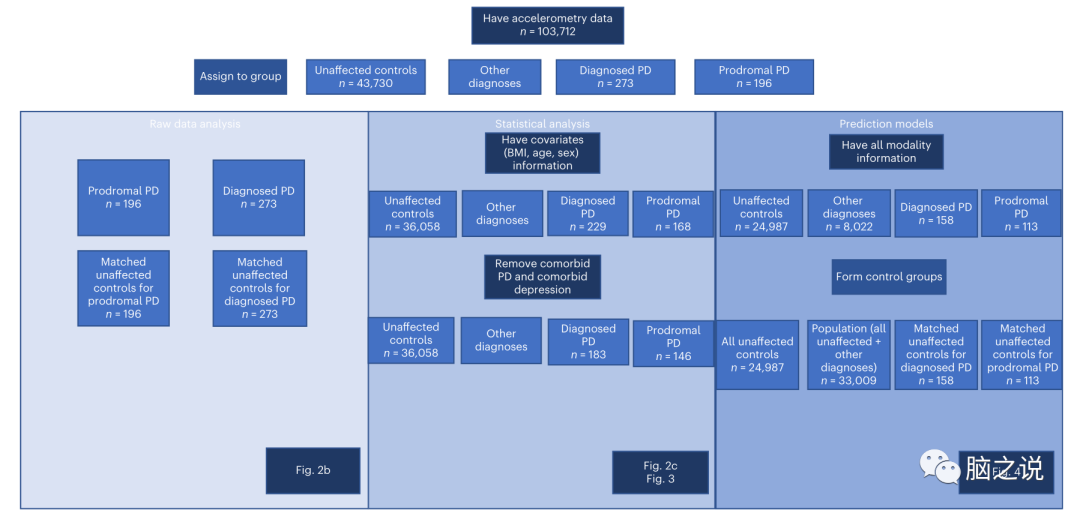
图1 已完成分析的概况-参与者流程图。我们会为每个分析显示有多少参与者被包括在内,以及为什么其他人被删除。从完整的UKBB数据集开始,我们首先关注那些有加速度计数据的人,他们根据我们的诊断提取方法被分配到不同的组。接下来是三种不同的分析。第一次分析是对原始加速度计数据进行的,其中未受影响的对照组与每个前驱和诊断病例相匹配。第二部分包括统计分析组比较,首先只保留有协变量信息的参与者,以便计算残差,然后去除合并抑郁和PD的病例。第三个分析构建了预测模型,其中只保留了所有预测因子的完整信息的参与者。探索了三种不同的对照组设置:匹配未受影响,所有未受影响和一般人群。
2. 方法
所进行的分析和包括的参与者的概述可以在图1中找到。
2.1 研究人群
UKBB拥有50万参与者的深入信息,并由研究伦理委员会批准。在应用程序代码69610下访问,数据发布到卡迪夫大学。UKBB取得了所有参与者的书面知情同意。我们探讨了PD及其相关疾病,即“全因痴呆”、“全因帕金森病”、“阿尔茨海默病”、“肌张力障碍”、“骨关节炎”和“抑郁症”。我们根据医院住院患者数据和死亡登记中的国际疾病和相关健康问题分类第十版(ICD-10)和第九版(ICD-9)中的代码确定患者组,这些数据来自UKBB提供的表格和密码,以及自我报告的诊。初级保健数据也包括在内,使用读取代码分别通过TRUD NHS读取浏览器映射的ICD-10代码。每种诊断的相应代码可在补充表2中找到。我们根据所有资源中最早报告的诊断日期,在加速度计数据收集日期区分了前驱(事件)和诊断(流行)病例,并允许两年的误差范围,这意味着在加速度计数据收集之前或之后两年内诊断的患者被归类为诊断/流行病例(图3a),而两年多后接受诊断的个体被标记为前驱/事件病例。未受影响的对照组被定义为在所有纳入的来源中没有神经、行为障碍或任何纳入的疾病,没有被全科医生(GP)开过抗帕金森药物或自我报使用抗帕金森药物。从未受影响的对照组中,我们随机抽取年龄和性别匹配的个体作为PD。仅包括通过加速度计数据质量控制的参与者。健康相关结果数据可获得至2021年3月。采用相同的方法,我们还确定了具有公认的前驱症状和体征的参与者,即抑郁、焦虑、体位性低血压、RBD、低血压、尿失禁和便秘。如果这些症状是在PD诊断前报告的,我们将其定义为前驱症状。我们对三个对照组进行了区分:(1)以1:1的性别和年龄匹配未受影响的对照组;(2)所有未受影响的个体;(3)一般人群的代表性样本,包括所有未受影响的对照组和被诊断患有其他疾病(如痴呆、肌张力障碍、骨关节炎和其他形式的帕金森病)的个体。方法的预测模型部分提供了每一组的进一步细节。
2.2 加速度计数据
在随机电子邮件招募后,103,712名同意参与的人在7天的时间里,在他们的左手上佩戴了一个在手腕上佩戴的AX3三轴加速度计。UKBB提供描述每日和每小时平均值的汇总统计(类别1009)。我们通过对原始数据进行预处理,并将30秒的时间间隔划分为体力活动类别,即输入、睡眠、久坐、轻度或中度至剧烈体力活动(MVPA),利用机器学习模型,使用带有马尔可夫混淆矩阵的平衡随机森林,使用牛津可穿戴设备小组提供的加速度计包3,增强了加速度测量数据。我们采用的预处理步骤与用于从UKBB导出汇总统计数据的步骤相同。这些步骤包括设备校准,重新采样到100赫兹和消除噪音和重力。对于睡眠,这需要测量睡眠质量;例如,夜间醒来的频率和白天打盹的频率。为此,我们只使用完整的数据集,因此对于每个参与者,不完整的小时或天,各自的测量感兴趣,被删除。我们为每个测量保留尽可能多的数据,导致不同的数据被用于不同的汇总统计。例如,连续参加一门体育活动课程的最长时间是根据所有可用数据计算的,而每24小时参加一门体育活动课程的平均时间是根据从上午10点开始的24小时的平均时间计算的。我们选择上午10点作为偏移量,因为数据收集是在这个时间开始的。这种数据的删除是为了避免偏差,通过更高的代表性的特定时间的一天。
2.3 额外的数据
我们合并了加速度计汇总统计(类别1009)、初次就诊时的血液生化测量(类别17518)、初次就诊时的身体健康测量(类别100006)、多基因风险评分(类别301)和我们得出的身体活动表型。我们进一步纳入加速度计数据收集时的年龄和性别。
2.4 统计分析
通过ukbb_parser5 (https://github.com/aschalkamp/ukbb_parser)的改编版本,便于从UKBB检索数据。在python v.3.8中使用scipy v.1.6.1、pingouin v.0.5.1 (ref.36)、scikit-learn v.0.23.2 (ref. 37)和sksurv .0.14.0 (ref.38)包进行数据处理和模型训练。使用python v.3.9、pingouin v.0.5.1 (ref.36)、seaborn v.0.12.1 (ref. 39)和matplotlib v.3.6.2进行统计分析并生成数据。所有python环境都在相关的GitHub存储库中提供。
2.5 患病率
我们通过比较观察到的和预期的患病率来验证我们建立的PD病例队列。从1950年到2021年,我们确定了每个年龄组确诊和未确诊病例的数量。根据死亡日期,参与者从死亡年份开始被排除在统计之外。我们根据2015年基于人群的研究中每个年龄组的存活人数和各个年龄组的患病率计算了每年PD病例的估计数量55。我们将这一预期患病率外推至2030年,假设没有死亡发生。
2.6 识别和调整协变量
年龄和性别是已知的加速度协变量。为了解决这个问题,我们以年龄和性别匹配的方式对未受影响的对照组进行了抽样。而前驱症状组与临床诊断组年龄差异有统计学意义。BMI也是加速度的协变量。为了解决这个问题,我们使用从未受影响的对照组(n=36,082)获得的年龄、BMI和性别系数,用包含截距的线性回归模型计算了平均加速度的残。由于缺少一些协变量的信息,这导致一些参与者被删除。在检查其他(非PD)诊断组时,我们删除了观察到共病PD的任何病例,以保持队列的同质性。我们还从所有其他(非抑郁)诊断组中剔除了抑郁症共病诊断的参与者,因为发现该诊断组加速度降低,抑郁是PD的前兆标志。
2.7 药物对加速的影响
我们使用初级保健处方记录来识别以下参与者:(1)曾经开过PD和帕金森病治疗的典型药物;(2)在数据收集前10周内接受过该药物的处方,因此在数据收集期间可能正在用药。读取代码取自UKBB文档(https://biobank)。共有513名UKBB参与者曾服用过PD药物。其中,302人不属于“全因帕金森病”组,206人属于已确定的帕金森病病例;在UKBB的3837例PD病例中,5.37%至少开过一次PD药物。2045例PD确诊病例GP信息缺失。我们使用发布日期和加速度计收集信息的日期将GP记录与加速度计数据进行匹配。在有加速测量数据的PD病例中,20例曾经开过药;在收集加速度计数据时,其中19人被诊断为帕金森病,1人被诊断为前驱帕金森病。其中6例,包括前驱症状患者,仅在收集加速度计数据后才开始用药(从加速度计数据收集到处方的平均天数:464.42±257.28),因此假设在收集数据期间未用药。在PD患者中,14例患者在采集加速度计数据前开始服药(从开药到采集数据平均天数:104.56±333.1),其中13例患者从开药到采集数据间隔不超过10周(从开药到采集加速度计数据平均天数:15.57±9.85)。我们比较了治疗(n=13)和未治疗(n=122) PD诊断病例的平均加速,发现没有显著差异,可能是因为样本量小。我们对年龄、性别和BMI校正后的剩余平均加速度重复了这一方法,得到了相同的结果(治疗组n=10,未治疗组n=103)(补充图4)。
2.8 预测模型
在扩展数据图1中可以找到带有结果定义和包含特征的训练模型的概述。为了量化个体水平上加速度数据的预测能力,并将其与其他模式进行比较,我们拟合了逻辑回归模型。我们确定了五种模式:遗传学、生活方式、血液生化、前驱症状和加速度计(表1)。对于每种模式,我们都包括了最新的可用信息,这意味着对于生活方式和血液模式,我们包括了首次就诊的特征,因为这些特征后来没有收集,对于前驱症状,我们检查了直到2021年3月(相关临床记录的最后更新)在PD诊断之前是否存在前驱症状。我们将数据集限制为具有所有五种模式可用信息的参与者。我们用逻辑回归和拟合的Lasso惩罚在交叉验证中估计了每种模式的预测性能。我们选择Lasso来增加我们模型的稀疏性,从而降低复杂性,这样模型将更稳定,更不容易过度拟合。选择逻辑回归作为二值分类任务中最简单的算法之一,是因为它具有较高的可解释性和突出性。训练了三种不同的模型类型:(1)诊断性生物标志物,从对照组中识别诊断PD (n-153);(2)前驱标志,将前驱PD (n= 113)与对照组区分开来;(3)从对照组中筛选、识别确诊和前驱PD (n=266)。
所有未受影响的对照组(n= 24,987)或一般人群的代表(n=33,009),包括未受影响的对照组和诊断为其他疾病的参与者,如痴呆、肌张力障碍、骨关节炎和其他形式的帕金森病(n=8,022,有合并症的参与者仅包括一次)。在对照组中,我们没有纳入单独诊断为抑郁症的参与者,因为在PD诊断前存在抑郁症是一个预测因素。我们在不同的模式上训练模型,总是包括协变量年龄、性别和一个截距:无技能(仅截距)、遗传、生活方式、血液、前驱症状、所有加速特征和所有模式组合(表1)。我们进一步训练模型,将每种模式的特征与所有加速特征结合起来。我们在嵌套的五重交叉验证中训练模型,对内部和外部分裂使用分层的五重分裂,这样在每个折叠中20%的数据用于测试,80%用于内部折叠。在内部折叠中,20%用于通过网格搜索验证最佳Lasso惩罚超参数(10到10之间的10等距值)。仅使用截距的无技能模型仅使用外部交叉验证褶皱进行训练,因为没有超参数必须在内部褶皱中拟合,因为这里没有应用惩罚。参数选择独立应用于每个外折叠。实值预测因子基于外分裂的训练数据进行标准化,使其标准差为1,均值为零。二进制数据被编码为0/1。采用平衡班级加权来调整班级不平衡。我们报告了AUROC和AUPRC在外部交叉验证分裂上的平均值和95% Cl,以比较模型。使用双侧t检验比较分类器的性能,并使用0.05的Bonferroni校正进行多重检验。我们将每种模态与加速度计模态进行比较(图5a-c)。我们进一步比较了每种单一模态与无技能性能,以及每种单一模态性能与其与加速度计模态结合时的性能。对于加速度计模型,我们将其单一性能与使用所有模态的模型进行了比较。我们显示了AUROC和AUPRC的平均曲线。每个模型的交叉褶皱。通过评估测试数据外部折叠上模型分配的PD的平均预测概率,我们确定了哪些疾病最有可能被模型错误识别为PD。我们通过计算五个外部交叉验证分割上每个预测因子的平均效应,进一步研究了特征重要性。我们通过检查它们在每个外部交叉验证分裂中的效应大小来验证它们的稳定性。如果跨折叠的平均效应大小显著不同于零,则标记为重要特征(95% bonferroni校正CI不超过零)。除了使用所有模式的联合特征的组合模型外,我们还进一步训练了一个堆叠模型,该模型从每个模式特定的模型中提取预测概率,并将其整合到最终的Lasso逻辑回归模型中,该模型预测患有或获得PD诊断的总体概率。因此,每个模态都被赋予一个系数,其预测有助于最终预测。与其他模型一样,该模型在相同的外部交叉验证分割上进行训练,使用它们对训练数据的预测来训练最终模型和用于测试的各自测试数据。这里没有惩罚超参数拟合,因此没有进行内部交叉验证。采用与AUROC和AUPRC类似的方式评估跨褶皱的性能,并通过检查平均值和标准差来评估跨褶皱分配系数的稳定。最后,我们进行了校准分析,研究了校准的大范围、校准斜率和校准曲线。
2.9 生存模型
我们探讨了每种模式的价值,以预测前驱PD队列的诊断时间。为此,我们首先计算了皮尔逊相关性(Pearson correlation)。在PD前驱队列中,有双侧的人的剩余平均加速(年龄和性别校正)和诊断时间。未发现残差平均加速度(年龄和性别校正)与前驱症状病例的诊断时间之间存在线性关联(r=0.11,P=0.13);也就是说,在接近诊断日期时,平均加速度似乎并没有进一步下降。然后,我们对前驱症状(n=113)和对照组(配对:n=113;未受影响的对照组:n=24,987;或人群:n=33,009)来预测每个个体何时被诊断(扩展数据图8)。为此,我们使用生存随机森林进行五倍分层交叉验证。生存随机森林由1000棵树组成,每棵树至少需要10个样本,每棵树至少需要15个样本。对照组被建模为右删节,因为我们不知道他们是否或何时会得到诊断。我们对从加速度计数据采集到PD诊断的时间进行建模,从而定义加速度计采集的时间为time0。对于前驱症状模式,我们将前驱症状的诊断时间限制在加速度计数据收集的日期,并删除所有后续的前驱症状诊断。样本规模(类不平衡)、每个病例和对照组的每个纳入特征的平均值和标准差在补充表9中给出。我们在五个交叉验证测试集上报告了随时间变化的AUROC(图5d-f)和综合Brier评分(补充图20)。这些指标是通过动态定义几个时间点的病例和对照来计算的,在PD诊断时,对照过渡到病例。在基于当前病例和对照分配的每个时间点,使用真阳性(敏感性)和假阳性率(1 -特异性)的标准AUROC评估预测的病例/对照分配。
3. 结果
UKBB提供了一个不断扩大的PD患者群体
UKBB中的临床诊断来自多种来源,包括自我报告的诊断、医院记录、死亡记录和初级保健数据。没有临床诊断验证,数据覆盖不完全。为了确保确定的PD队列既没有高估也没有低估,我们将我们队列中的患病率与2015年英国人口统计数据的预期患病率进行了比较到2021年3月,总共有-0.76%的UKBB参与者被诊断患有PD。总体而言,观察到的PD病例数略低于2015年英国人口统计数据(2015年预期:2252.61;2015年观察到:1984例)(扩展数据图2和图2),假设没有进一步死亡发生,到2030年预计有5255例。总的来说,我们发现UKBB队列中PD的患病率和发病率与该人群的预期非常相似。
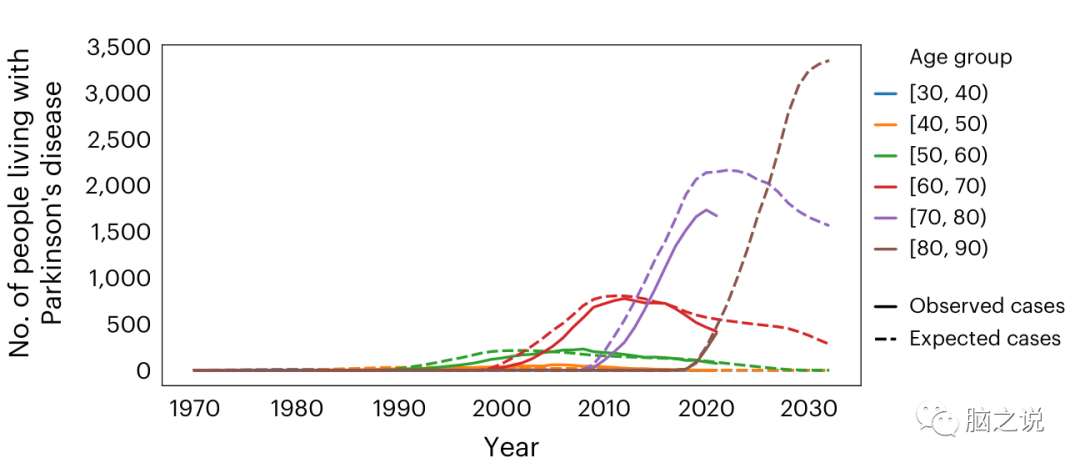
图2 估计和观察到的UKBB PD患病率。估计(虚线)和观察(实线)UKBB年龄组内PD患者随时间的数量。估计的病例数使用了2015年英国基于人口的统计数据。
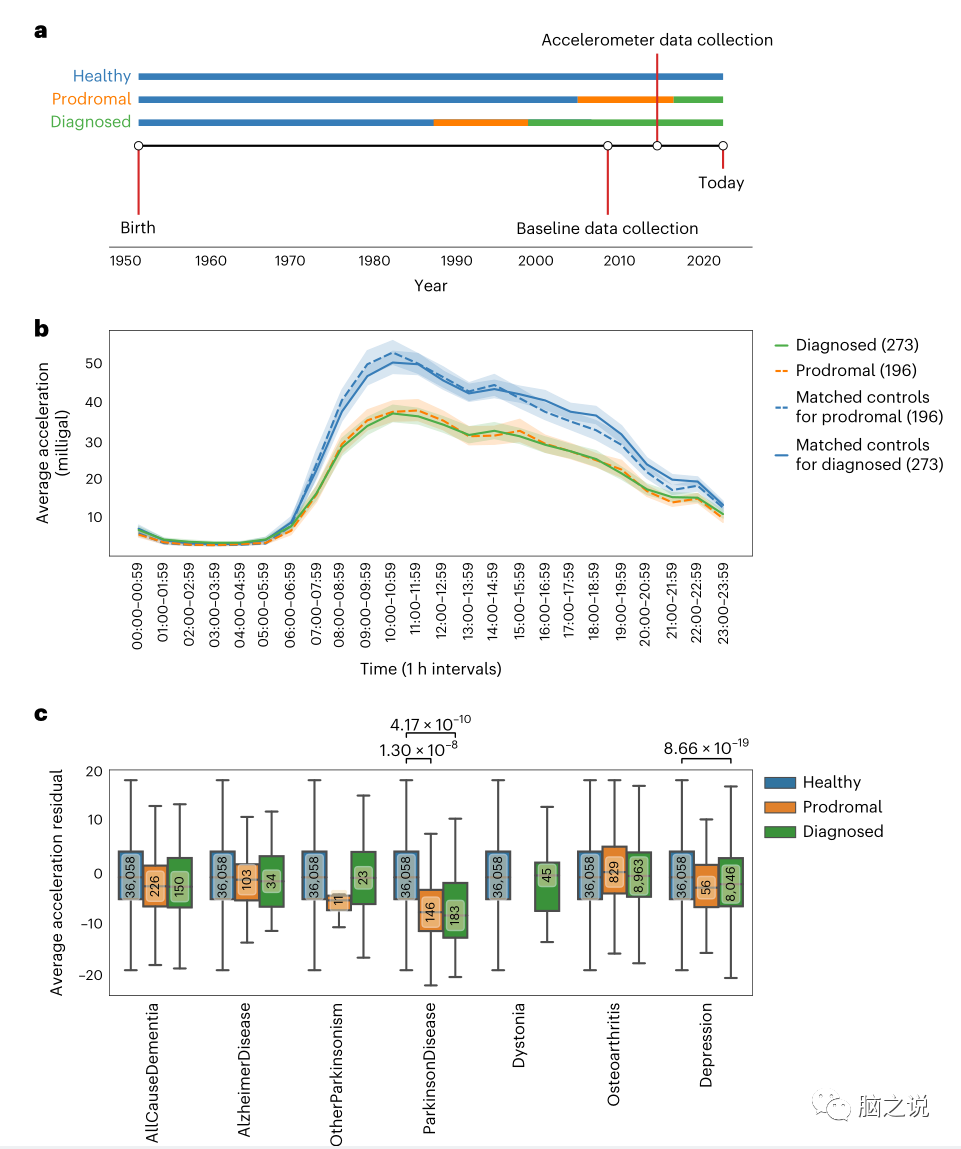
图3 诊断前加速度降低是PD独有的。a: 2006年至2010年期间收集的基线数据;加速测量数据是在2013年至2015年间收集的。诊断病例(绿色)在加速度计数据收集之前或随后的两年内被诊断出来。前驱症状病例(橙色)在加速度计数据收集后两年或更长时间被诊断。b:平均加速度以毫克(0.01毫米秒)为单位,在一天的过程中每隔1小时显示一次。前驱症状参与者的组均值(n= 196,橙色,虚线),与前驱症状匹配的未受影响的对照组(n= 196,蓝色,虚线),诊断的参与者(n= 273,绿色,实线)和与诊断的参与者(n= 273,蓝色,实线)匹配的未受影响的对照组(n= 273,蓝色,实线)分别用各自的95%. c: 绘制在七个疾病组和未受影响的对照组中显示了诊断为共病抑郁症或PD的患者去除后的无磨损时间偏差校正的平均加速度。没有这些调整的分析可以在补充图2中找到。对于每个诊断组,我们区分诊断(绿色)、前驱(橙色)和健康(蓝色)。每组的人数在中间的方框中显示。箱形图以平均值为中心,25%和75%四分位数为框界。
在帕金森病诊断前几年加速下降
我们比较了诊断组在7天内每天每小时的平均加速度。在收集加速度计数据时或两年内,273名参与者被诊断为PD(自诊断以来的平均年数:5.04±6.37)(补充表1和图3a)。另外196名患者在加速测量数据收集两年后接受了新的PD诊断,形成前驱组(平均诊断年数:4.33±1.30)(图3a)。前驱症状组明显大于诊断组(t-statistic=3.26, d.f =453, P=1.2 ×10-3, 95%)。我们随机抽取年龄和性别匹配的未受影响的对照组(1:1),分别为每一个被诊断为帕金森病的参与者和每一个将被诊断为帕金森病的参与者。前驱(从早上7点开始)和确诊的PD病例(从早上7点开始)。与年龄和性别匹配的未受影响的对照组相比(图3波段补充表3),在上午7点至午夜12点之间的所有小时内,P-3.7 x 10-5至12点P-1.4 x 10-3)的加速度曲线都显着降低。从午夜12点到早上7点的平均加速度没有差异。(补充表3)。因此,在临床诊断前几年,可以观察到白天加速度的降低。
在诊断前没有其他疾病显示出类似的减少
由于个体之间的身体活动与健康状况无关,因此我们探讨了所观察到的加速度降低是否仅为PD独有,或者是否也可以在其他临床疾病中观察到,特别是其他神经退行性和/或运动障碍(补充表1)。性别和身体质量指数(BMI)通过未受影响的对照组(n =36,058)训练的线性回归模型(补充表4)。正如预期的那样,一些参与者被诊断患有多种合并症,因此那些患有PD合并症或合并诊断为抑郁症的参与者被排除在外。与未受影响的对照组相比,PD诊断组(t统计量=6.25,P=4.17 × 10-10)和PD前驱期(t统计量= 5.69,P=1.3 × 10)的剩余平均加速度显著降低(图3c和补充表10),但PD前驱期和PD诊断组之间无显著差异(P=0.88)。我们没有发现PD治疗对诊断为PD的患者的平均加速有显著影响(补充图4)。在被调查的患者中,“抑郁症”是唯一一种发现在诊断后加速降低的疾病。在诊断前,所有被调查的疾病均未发现加速降低,而PD则观察到这一点(图3c)。总的来说,在诊断前和诊断后加速降低的发现是PD独有的,这表明这种测量方法是疾病特异性的,有可能用于早期识别可能被诊断为PD的个体。
PD患者的睡眠比其他疾病更容易中断
我们下载并提取了患有上述任何疾病和未受影响对照者的原始加速度计数据的睡眠特征;总共处理了65,901人的数据。我们使用预训练随机森林标记体育活动类别,并从晚上11点到6点59分派生出每个活动类别的特征上午及日间,上午7时至晚上10时59分我们根据从未受影响的对照组获得的信息,对这些提取的特征进行了年龄、性别和BMI校正。从加速数据得出的睡眠特征表明,在前驱期和被诊断为PD后,睡眠质量和持续时间都有所下降(图4和补充表11-15)。与未受影响的对照组和PD前驱期组相比,诊断为PD的个体总体睡眠时间更少,连续睡眠时间较少,白天睡眠频率较高。与未受影响的对照组相比,前驱期PD患者和诊断为PD的患者夜间醒来频率更高,前驱期和诊断为PD的队列之间无显著差异。PD前驱期患者比未受影响的对照和诊断为PD的患者睡眠时间更长(P=1.78×10)。对其他诊断队列的检查发现,与PD相比,睡眠测量的恶化程度较小(图4和补充表11-15)。在不同的诊断组中,不间断睡眠的长度是组间最常见的差异特征。在诊断后,“全因痴呆”、“骨关节炎”和“抑郁症”组的患者夜间醒来的次数更高;然而,没有一个诊断组在前驱阶段表现出这种特征的减少,而在PD中发现。
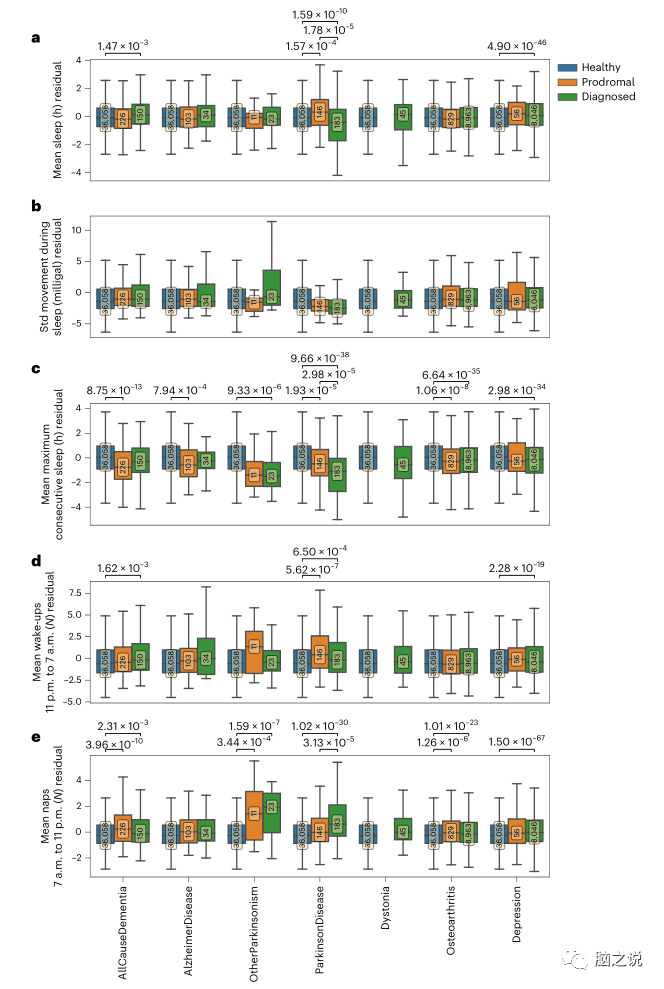
图4 PD前驱期夜间醒来增加,但其他任何前驱期均无。a-e: 在剔除诊断为共病抑郁症或PD的病例后,5个残差(通过未受影响的对照队列进行年龄、BMI和性别校正)加速度计得出的睡眠特征的箱形图显示为5个疾病组和未受影响的对照组,以平均值为中心,25%和75%四分位数为框界。补充图3显示了相同的分析,但未排除诊断为共病抑郁症的病例或PD。由于协变量校正包括协变量效应的减法,结果不能反映变量的真实值,从而导致潜在的负值。对于每个诊断组,我们区分诊断(绿色)、前驱(橙色)和健康(蓝色)。每组的人数在中间的方框中显示。
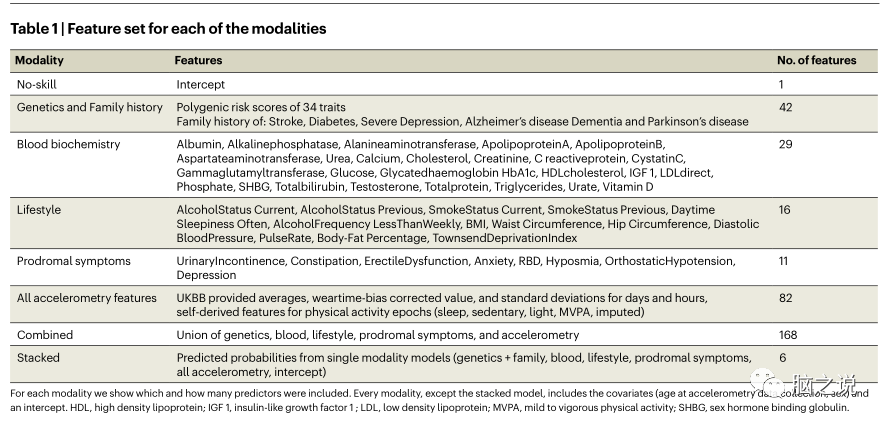
表1 每种模式的特征集
加速度测量数据预测PD前驱
Wenext使用最小绝对收缩和选择算子(Lasso)逻辑回归模型,以平均加速度、年龄和性别为特征,探索了按照TRIPOD报告指南的加速度测量数据在个体水平上的精确召回曲线下面。选择AUPRC是因为数据集不平衡。分类患病率用N_cases/(N_cases +N_control)表示。平均加速度将诊断为PD的个体(n =153)与匹配的未受影响的对照组(n =153)区分开来,平均AUPRC为0.78±0.06,能够区分前驱PD(n=113)和未受影响的对照组(n=113),且表现相同。从未匹配的未受影响的对照组(n= 24,987)中识别出确诊的PD和前驱PD,其评分分别为0.09±0.05(患病率= 0.0061)和0.09±0.02(患病率= 0.0045)。在包括所有未受影响的对照组在内的普通人群队列中,仅使用AUPRC值分别为0.05±0.04(患病率= 0.0034)和0.06±0.05(患病率= 0.0046)的平均加速度,就可以识别出前驱期和诊断为PD的PD,以及“骨关节炎”、“肌张力障碍”、“其他帕金森病”和“全因痴呆”(n= 33,009)的前驱期和诊断为PD的病例。添加衍生的身体活动和睡眠特征(补充表5)将模型从一般人群中识别PD诊断个体的性能提高到0.14±0.04 AUPRC,从一般人群中识别前驱PD的性能提高到0.07±0.03。与使用平均加速度的模型相比,仅在诊断的PD模型中,性能的提高是显著的(P=0.01)。在所有设置中,最可靠的选择特征是epoch期间的平均加速度,被归类为轻度身体活动,这降低了患/患PD的风险(扩展数据图3e-5e和6以及补充图13e-15e);这意味着在正常的身体活动中运动缓慢可以预测前驱和确诊的帕金森病。
加速度测量数据优于已知的PD前驱标志物
以前已经探索了几种模式,以确定前驱PD的价值;然而,这些研究通常是在孤立的和临床精炼的队列中进行的,而不是在一般人群中进行的。在这里,我们检查了基因,生活方式,血液生化。我们在这些不同的模式上训练Lasso逻辑回归模型,以识别来自三个不同对照组的诊断(n=153)或前驱(n=113) PD(补充表9)。以生活方式、血清生化血液标志物、公认的前驱症状或遗传因素训练的模型显示,AUPRC得分低于以加速度计特征训练的模型。可能是因为其更高的疾病特异性(图5a-c,补充表5和扩展数据图7)在所有情况下,与遗传、生活方式和血液生化相比,采用加速度计模式均有显著改善(补充表6)。例如,从一般人群中识别前驱症状病例:遗传学的AUPRC为0.01±0.00,生活方式的AUPRC为0.03±0.04,血液生化的AUPRC为0.01±0.00。与前驱症状相比,只有在一般人群对照中才有明显的改善,其中前驱症状的AUPRC达到0.01±0.00。
我们进一步将每个模态特定模型与无技能分类器进行了比较(补充图5和6)并注意到遗传、生活方式和血液生化在某些情况下的表现不优于该基线(补充表6)。接下来,我们将每个单一模式模型与其各自的组合模式进行了比较,其中加速度计模式被添加到预测因子中。在诊断的PD模型中,在所有对照设置中,联合模型总是优于单一模态模型(补充图5)。对于前驱PD,在前驱症状中加入加速度计只会在一般人群设置中导致改善(补充图6)。因此,当对照组不包括诊断为相关疾病的参与者时,前驱症状模态在识别前驱PD方面表现相似。在任何情况下,结合所有可用模态的模型都没有优于单一加速度计模型的表现,这可能是由于每种模态捕获不同程度的相同信息。总的来说,加速度测量法表现最好,尤其是在普通人群中。接下来,我们评估了每个模态中的哪些因素被认为是最相关的,并提供了一个模态中有多少特征在组合模型中是重要的度量。我们将第二次分析限制在使用匹配的未受影响控制的模型上。组合模型中最重要的特征与特定模态模型中的特征相似。在联合模型中最重要的特征中,加速度测量模式的特征所占比例最大(识别前驱PD的模型占67%,识别诊断PD的模型占50%)(扩展数据图3f)。第二种模式,按照对模型的重要性排序,是以PD的多基因风险评分为重要特征的遗传标记。因为与其他模态相比,加速度计模态具有最多的特征(表1),有人可能会认为它们的重要性纯粹是因为它们的维度。我们通过堆叠模型对此进行了研究,其中特定模态模型的预测概率作为最终逻辑回归模型的输入。这也确定了加速度计是最重要的。
加速度测量数据预测PD诊断所需时间
诊断时间的估计不仅具有潜在的临床效用,而且在评估神经保护疗法疗效的临床试验中也很重要。因此,接下来探讨哪种模式最有利于预测PD的临床诊断时间。使用生存随机森林模型预测诊断时间,采用与先前用于逻辑回归模型的模态特定建模方法相同的方法;然而,在这里,我们只关注前驱PD和与三个对照组相比的诊断时间建模(扩展数据图8)。我们选择了AUROC下的时间依赖区域来评估我们的模型,这是一个衡量模型在指定时间点内与对照组相比识别所有现象转换病例的能力的指标。基于加速度特征训练的模型,在匹配的未受影响的健康对照组中,平均AUROC为0.74±0.04;在所有未受影响的对照组中识别出前驱症状病例时,平均AUROC为0.86±0.06;在普通人群中训练时,平均AUROC为0.84±0.04(图5d-f)。由于在观察到的时间范围内,生存等级(右审查)超过了接受PD诊断的人数,AUROC评分只能以比较的方式进行评估,因为在这种不平衡的情况下,这个指标可能过于乐观。随着时间的推移,加速度计模型比任何其他单一模态模型都能更好地预测PD诊断的概率,并且与组合模型相似(图5d-f)。这一发现突出表明,加速度数据不仅使我们能够预测谁会发展为PD,而且还可以预测何时可能会诊断为PD。
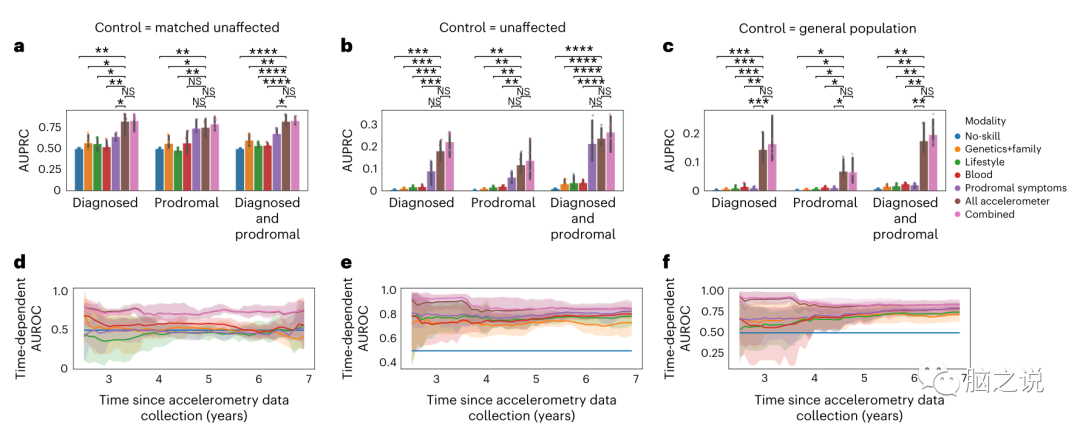
图5 加速度计识别PD和预测诊断时间比任何其他风险因素更好。a-c: 条形图表示使用不同特征集的每个逻辑回归模型的性能(表1)。五个外部交叉验证折叠的平均AUPRC用误差条表示bonferroni调整的95%。每折叠一次的个人表现用点表示在条形图上。我们在无技能的情况下展示了这一点,五个单一模态模型和一个组合模型用于三个不同的任务,三个不同的对照组,(a) 匹配的未受影响的对照组,(b) 所有未受影响的对照组和(c) 一般人群。d-f: 生存模型的性能评估以时间依赖的方式提供,其中性能评估是在确定所有现象转换病例与尚未转换或审查的控制到指定的时间点。绘制了几个评估时间点(自收集数据以来的年份)随机生存森林的平均随时间变化的AUROC,以及自加速度计数据收集以来7年的五个外部交叉验证折叠得出的经bonferroni调整的95% Cl。我们为(d)由匹配的未受影响的对照组组成的对照组,(e)包括所有未受影响的对照组和(f)代表一般人群的对照组展示了这一点。
4. 讨论
在这里,我们展示了加速计作为筛查PD的生物标志物的潜力。我们发现,在临床PD诊断前几年,加速降低就已经表现出来了。这种诊断前加速减少是PD所特有的,在任何其他疾病检查中都没有观察到。通过比较加速度计与遗传学、生活方式、血液生化和前驱症状等其他模式的预测价值,我们发现没有其他数据模式在识别PD的未来诊断方面表现更好。
最后,我们发现加速度计可以预测PD诊断的时间点。这项工作建立在先前的临床数据,已经证明在PD的前驱期异常运动功能。Darweesh等人表明,在临床诊断前7年,日常生活活动障碍和行动迟缓的迹象就已经出现。同样,内贾德等人也是如此。分析了RBD患者纵向队列中多个前驱标志物的时间演变,并强调了早期运动症状在诊断前6年识别前驱PD的预测潜力。然而,这些工作仅限于高风险RBD人群或在临床环境中进行的评估,这需要增加亲自访问的成本和时间。之前的工作已经探索了使用数字步态标记来诊断PD1314.23。例如,Williamson等人也利用UKBB数据证明了PD诊断病例的高准确性。然而,他们关注的是流行的PD病例,并没有探索在临床诊断前使用这些数字标记来识别PD的可能性。迄今为止,唯一一项使用步态测量传感器调查前驱帕金森病的研究仅限于16名参与者。此外,该研究中获得的步态数据是在指定任务期间在诊所收集的。其他数字标记物已被研究作为潜在的前驱生物标记物。例如,在家中通过无线电波收集的夜间呼吸模式已被证明可以在临床诊断前将12例前驱症状患者中的75%识别为PD。使用UKBB数据评估了几种神经退行性疾病(包括PD)诊断前的认知和功能障碍。然而,在先前使用加速度计数据的研究中,没有报道到一般人群的可转移性和疾病特异性。总的来说,我们确定了研究中的五个主要空白,我们目前的工作旨在解决:研究(1)PD的前驱期被收集,(2)基于真实世界运动传感器的数据,(3)大样本量,(4)同时将其性能与其他已建立的标记进行比较,(5)其对一般人群的普遍性。据我们所知,通过使用数据收集后转化为PD的大量个体样本,我们首次证明了基于加速度计的生物标志物与普通人群中其他前驱PD标志物的临床价值。在普通人群中使用加速度计数据进行筛查是可行的,因为这些数据很容易获得。大多数人每天都在使用能够收集加速度计数据的智能设备。需要克服的挑战包括测量的有效性和能力、数据隐私和责任问题。此外,处理由数字传感器产生的大量数据需要耗费大量的资源和时间。正如我们在这里演示的那样,一周的数据可以预测未来几年,因此可以采用较长的评估间隔,从而减少资源需求。如果这些限制得到解决,可穿戴设备和其他健康传感器设备有能力将医学转变为数字健康时代,改善偏远地区的可及性,降低成本并改善医疗保健。”本研究有几个局限性,主要是缺乏外部复制,尽管进行了广泛的交叉验证以试图减轻任何队列特异性偏差。这在很大程度上与缺乏另一个在规模和数据量方面相当于UKBB的数据集有关,该数据集将允许对多种疾病的前驱期进行回顾性研究。例如,虽然帕金森氏症进展标志物倡议2队列提供了158例前驱症状队列的智能手表数据,但这里的前驱症状被定义为有风险的人,而不是随后接受PD诊断的人。
应当注意到有关UKBB内部数据可用性的若干限制。对于大多数人来说,加速度计数据只在一个7天的时间内收集,这就是为什么我们将分析限制在这个时间范围内。关于加速度的纵向数据将允许。个人轨迹的研究。此外,一些临床公认的前驱症状标志物,如多巴胺转运体成像或运动检查,在UKBB中不可用,因此无法与加速度计数据进行比较,尽管它们被公认为具有很高的预测能力。由于我们选择加速度计数据收集的时间作为分组分配的定义时间点,这限制了与在此之前收集的其他数据(如生活方式和血液生化)的比较。此外,并非所有纳入的特征都可用于所有参与者,因此,模型仅针对可获得完整信息的个体子集进行训练,人为地减少了我们的样本量,但允许模型之间更大的可比性(表1)。值得注意的是,UKBB中的数据可用性并不反映模型的实际可用性。例如,遗传数据在现实生活中更稀疏,但在UKBB中优先考虑,而加速度计数据在现实生活中为许多人收集,但仅为UKBB中的一个子集收集。下载和处理原始加速度计数据非常耗时(从一个参与者下载数据需要30秒(-250 MB),处理时间需要-3分钟),因此我们将分析限制在已确定的感兴趣诊断和未受影响的对照组。这限制了我们的模型在临床实践中的可移植性,因为它并没有被训练成一个完美的代表一般人群。最后一个限制是我们对模型的选择。使用Lasso逻辑回归,我们专注于低复杂性的可解释模型。使用类加权,我们在模型训练中优先考虑敏感性而不是特异性,从而创建了一种筛选工具,而不是临床诊断的替代品。探索允许非线性的更先进的模型可能会进一步提高模型的性能。总之,我们的研究结果表明,在普通人群中使用可穿戴设备收集的加速度计可以用于识别PD风险升高的人群,其规模前所未有,重要的是,在未来几年内可能转变的个体可以被纳入神经保护治疗的研究中。
参考文献:Wearable movement-tracking data identify Parkinson’s disease years before clinical diagnosis.
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
