Nature Reviews Neurology|帕金森病治疗:当前策略与未来研究重点
原创Nature Reviews Neurology|帕金森病治疗:当前策略与未来研究重点
原创
摘要:帕金森病(PD)是全球增长最快的神经系统疾病,由于进行性残疾、左旋多巴抵抗症状的出现以及治疗相关并发症,给管理带来了巨大的挑战。在本综述中,我们探讨了当前PD治疗的研究现状,并概述了未来推进疾病理解和治疗的优先事项。我们确定了未来几年的两个主要研究重点:首先,通过整合敏感的生物标志物和靶向生物疗法来减缓疾病进展;其次,通过改进现有的症状治疗方法(包括手术和输注疗法)来推迟并发症的发生并改善患者的长期管理。疾病修饰的道路因PD的多方面病理生理学和多样化的机制而受阻。正在进行的研究主要集中在α-突触核蛋白聚集上,同时也在努力解决与较少见的遗传形式相关的特定通路。这些努力的成功依赖于建立可靠的终点、整合技术以及识别用于早期诊断和持续监测疾病进展的生物标志物。在症状治疗的背景下,重点应转向改进现有方法,并促进针对左旋多巴抵抗症状和严重影响生活质量临床表现的新型治疗策略的开发。
1. 引言
帕金森病(PD)是全球增长最快的神经系统疾病;1990年至2015年间,患病人数翻了一番,超过600万。主要由于寿命的延长,预计到2040年这一数字将再次翻倍,超过1200万。其他因素,包括吸烟率的下降和工业化程度的提高,可能会使负担增加到1700万以上。
随着疾病的进展,多巴胺能疗法对PD主要特征(即震颤、运动迟缓和强直)的益处逐渐减弱,使得病情管理变得越来越困难。此外,对治疗反应不佳的症状,包括步态和平衡问题、自主神经功能障碍和认知缺陷,可能会逐渐发展,导致疾病进展轨迹的显著变异性。目前的症状治疗对多巴胺反应性症状有效,但不能预防——甚至可能加剧——运动并发症,这些并发症与非多巴胺能症状一起,显著导致残疾和丧失独立性。相关的医疗、社会和经济负担凸显了针对疾病进展机制的有效治疗的必要性,并最终改善患者的预后。现有证据表明,在大多数情况下,α-突触核蛋白寡聚体、纤维和路易体的形成在PD发病机制中起关键作用,尽管这一过程的触发因素仍然未知。在一部分个体中,基因突变和其他病理也参与了神经退行性变,无论是否直接涉及α-突触核蛋白。
在本综述中,我们探讨了当前PD治疗的重点,强调了近期临床试验的结果。此外,我们评估了基础和转化研究的发现,这些研究显著增强了我们对PD病因和治疗的理解,指出了疾病修饰和症状缓解的新途径。我们确定了基础和转化研究及临床试验中值得进一步探索的具体领域,最终目标是增强现有的PD治疗策略,并为未来的治疗方法奠定基础。
2. 当前的治疗现状
目前,没有任何治疗干预能够改变PD的疾病进展,多巴胺替代疗法和左旋多巴仍然是金标准治疗。随着疾病的进展,患者的治疗需求也在变化,药物或神经调节设备辅助疗法通常用于管理更晚期阶段的运动并发症。
PD早期阶段的治疗基于左旋多巴的使用,可以联合多巴胺激动剂和单胺氧化酶B(MAO-B)抑制剂。多巴胺激动剂,如罗匹尼罗、普拉克索和罗替戈汀,被引入以延迟运动并发症并减少左旋多巴的使用——这一概念得到了多项试验的支持,在这些试验中,开始使用多巴胺激动剂的患者长期运动并发症的风险低于开始使用左旋多巴的患者。在20世纪90年代,这些发现导致护理标准从主要使用左旋多巴转变为早期使用多巴胺激动剂,特别是在发病年龄较轻的患者中。目前,控释口服罗匹尼罗、普拉克索片剂和罗替戈汀的透皮制剂已经上市,但在过去十年中,它们的使用与白天嗜睡、腿部水肿和冲动控制障碍等不良事件相关,导致处方剂量减少。此外,早期使用多巴胺激动剂在长期残疾和生活质量方面与早期左旋多巴单药治疗相比没有显著差异的观察结果,限制了它们在PD初始阶段的使用。
MAO-B抑制剂司来吉兰和雷沙吉兰不可逆地阻断MAO-B,从而减缓大脑中多巴胺的清除,可以作为单药治疗或与左旋多巴或雷沙吉兰联合使用。雷沙吉兰被广泛批准用于早期PD治疗,而许多国家尚未批准司来吉兰用于此适应症,可能是由于其类似安非他命的代谢物对心血管的不良影响。
对于有运动波动的患者,治疗策略主要依赖于药物剂量调整、按需治疗以及在选定的情况下实施设备辅助疗法,以减少“关”期持续时间并改善异动症。大量实验室证据表明,运动并发症是由于间歇性标准口服左旋多巴剂量导致的非生理性大脑多巴胺恢复以及左旋多巴通过5-羟色胺能末梢代谢为多巴胺的结果。然而,即使是最先进的药物输送和神经调节方法也无法为大多数患者提供最佳的运动并发症控制,这表明理想的持续多巴胺能刺激尚未实现。未能实现这一目标的部分原因是克服影响左旋多巴药代动力学、吸收和运输的外周因素的限制,以及与突触改变和多巴胺能与其他儿茶酚胺能末梢相互作用相关的中央药效学变化。最重要的是,突触前和突触后事件的相互作用以及异常的大脑可塑性是运动波动和异动症的关键因素,而目前的治疗方法未能充分解决这些问题。
常见的运动波动患者策略包括缩短左旋多巴剂量间隔;早期使用儿茶酚-O-甲基转移酶(COMT)抑制剂,如恩他卡朋或奥匹卡朋,和/或MAO-B抑制剂如司来吉兰、雷沙吉兰、沙芬酰胺或唑尼沙胺;增加或增加多巴胺激动剂的剂量;以及使用金刚烷胺(如果存在异动症)。沙芬酰胺是最近批准用于运动波动患者的药物之一,作为左旋多巴的附加治疗。它具有独特的作用机制,既有多巴胺能(作为MAO-B抑制剂)作用,也有谷氨酸能(通过Na+通道阻断)作用。III期试验、事后分析和真实世界经验的结果表明,沙芬酰胺对运动和一些非运动(例如疼痛、情绪和睡眠)症状有有益影响。
COMT抑制剂的早期使用受到了相当大的临床关注,特别是随着每日一次的奥匹卡朋给药的引入。这种方法不仅提供了便利,还提供了在运动波动出现时改变左旋多巴外周可用性的主要策略。2022年发表的研究表明,奥匹卡朋有效缓解了左旋多巴血浆水平的波动,可能推迟了剂量增加和频率调整的需求。
设备辅助疗法,包括手术治疗,在管理运动波动患者中变得越来越重要。皮下阿扑吗啡和左旋多巴-卡比多巴空肠输注系统的疗效已经得到广泛证实,其益处已通过随机研究和全球许多中心的长期经验得到确认。输注疗法的基本原理是通过连续药物输送系统实现持续的多巴胺能刺激。左旋多巴或阿扑吗啡的恒定血浆水平最小化了多药治疗的不良事件(从而提高了治疗依从性),减少了多巴胺超敏反应,并最小化了运动并发症的基本机制。
手术神经调节技术,特别是丘脑底核或苍白球内侧的深部脑刺激(DBS),已被广泛证实可以改善晚期PD患者的运动波动和异动症。DBS也在早期出现运动波动的PD患者中进行了评估,结果显示与最佳药物治疗(即口服药物治疗)相比,DBS改善了生活质量。
磁共振引导聚焦超声(MRgFUS)已成为治疗药物抵抗性PD患者的一种有前途的非侵入性技术。MRgFUS已显示出显著减少药物和非药物状态下的运动障碍评分。然而,这些评分在手术后往往会随着时间的推移而增加,表明治疗效果可能下降,并强调了进一步纵向研究的必要性。在这种情况下,MRgFUS的一个显著优势是可以重复治疗。由于MRgFUS主要针对左旋多巴抵抗性震颤等症状,观察药物关闭期间的改善对于准确评估手术干预的益处尤为重要。然而,药物开启状态下观察到的改善进一步强调了治疗的整体疗效。
这些治疗方法都导致“关”期和异动症的减少,但并不能完全控制这些症状或改变疾病进展。此外,在PD的晚期阶段,患者可能会出现各种对左旋多巴无反应的非运动症状,这些症状严重损害了他们的生活质量,包括疼痛、疲劳、痴呆、自主神经功能障碍和睡眠-觉醒周期调节障碍。痴呆和其他认知表现,如精神病,可能会显著降低患者进行日常生活活动(ADLs)的独立性。从神经病理学的角度来看,PD患者的痴呆与边缘和新皮质结构中的路易体病理(具有特征性的皮质路易体)相关,通常伴有脑淀粉样β病理。目前可用的治疗方法对认知功能障碍的影响非常有限。
3. PD研究管线
未来的PD管理将需要继续使用能够缓解症状表现的药物,同时探索具有潜在疾病修饰特性的药物。疾病修饰指的是通过保护或恢复神经元功能来减缓或阻止疾病进展的干预措施。为了实现这一目标,需要确定可靠的试验终点和可靠的生物标志物,以准确跟踪疾病进展。
McFarthing等人报告称,截至2023年1月,根据ClinicalTrials.gov网站,有139项临床试验正在探索候选PD疗法。在这些注册的试验中,76项(55%)专注于症状治疗,63项(45%)专注于疾病修饰疗法(DMTs)。作者指出,DMTs试验与症状治疗试验的比例略高于往年。值得注意的是,139这个数字仅指药理学和生物制剂试验,不包括任何评估医疗设备、生物标志物或行为和其他生活方式干预的试验。
研究管线的一个令人鼓舞的特点是目标、机制和药物输送系统的多样性。有趣的是,非多巴胺能症状缓解试验占活跃试验的最大比例(28%)。这些试验的结果应提供有价值的见解,并强烈影响未来的研究。
3.1 症状治疗
左旋多巴仍然是最有效且耐受性良好的抗帕金森病药物,但其血浆半衰期短,即使与酶抑制剂联合使用也是如此。IPX203是一种新型的缓释左旋多巴-卡比多巴口服制剂,以胃滞留胶囊形式给药,已证明可以延长左旋多巴的吸收,并可能具有优于其他长效制剂的左旋多巴血浆曲线。RISE-PD研究在患有运动波动的PD患者中证明,IPX203在减少“关”时间方面优于速释左旋多巴-卡比多巴,尽管IPX203每天仅给药三次,而速释左旋多巴-卡比多巴平均每天给药五次。
皮下给药是另一种进一步改善左旋多巴输送的创新方法,两种用于连续输注的药物制剂已完成测试。在III期随机双盲试验中, ND0612(一种液体左旋多巴-卡比多巴制剂)显示出改善“关”时间和异动症的疗效,两项试验均达到了其主要终点,即增加无麻烦异动症的“开”时间。并在皮下给药24小时后保持稳定的左旋多巴和卡比多巴血浆水平。
一项概念验证研究探讨了在口腔内持续释放小剂量左旋多巴-卡比多巴是否可以提供持续的左旋多巴血浆水平。与间歇性口服左旋多巴-卡比多巴治疗相比,持续口服给药产生的左旋多巴血浆浓度变异性较小,平均“关”时间减少了43%(P<0.001)。持续口服左旋多巴治疗可能为早期实施非侵入性药物输送提供新的机会。一项II期试验测试了一种可以含在口中并持续释放左旋多巴-卡比多巴的微泵(DopaFuse)。与口服左旋多巴-卡比多巴相比,DopaFuse持续给药左旋多巴-卡比多巴与左旋多巴血浆水平的变异性减少相关(平均±标准差左旋多巴波动指数从第1天的2.15±0.59降至第2天的1.50±0.55(P=0.0129)和第3天的1.03±0.53(P<0.0001))。这种药代动力学的改善转化为DopaFuse治疗的“关”时间显著减少(第15天减少1.72±0.37小时;P=0.0004)和无严重异动症的“开”时间增加(第15天增加1.72±0.37小时;P=0.0004)。DopaFuse治疗未与任何临床相关的不良事件相关。
类似的技术进步正在测试中,以改善其他PD药物的给药,旨在产生更好的症状控制和生活质量。例如,每周一次的皮下给药聚合物连接的罗替戈汀显示出相对恒定的药物血浆水平,并且安全且耐受性良好。
除了改善现有药物的输送方法外,研究人员还在研究用于PD症状治疗的新药物。Tavapadon是一种新的多巴胺激动剂,刺激D1和D5受体。III期关键试验达到了其主要和次要终点,Tavapadon作为左旋多巴的辅助治疗,与左旋多巴加安慰剂相比,产生了临床意义和统计学上显著的无异动症“开”时间增加1.1小时,并且“关”时间显著减少。Tavapadon在早期PD患者中的III期研究结果预计将很快公布。
Mesdopetam是一种新的多巴胺D3受体拮抗剂,具有抗异动症和抗精神病特性。2023年报告的一项IIb期研究表明,该药物显著减少了异动症,而不损害正常运动功能,并且其疗效通过“关”时间的明显减少得到进一步加强。
另一种正在PD中测试的治疗方法是递送治疗基因,如CDNF(编码胶质细胞系源性神经营养因子)或AADC(编码芳香族氨基酸脱羧酶),以增强多巴胺产生神经元的存活和功能。2024年1月发布的一份新闻稿宣布了一项18个月的Ib期临床试验AB-1005(以前称为AAV2-GDNF)的初步结果,以评估一次性双侧直接递送至壳核的安全性(NCT04167540)。11名患者被分配到两个PD队列:轻度阶段(n=6)和中等阶段(n=5)。AB-1005的神经外科递送在所有患者中均耐受良好,目标壳核覆盖率为63%±2%,超过了大于50%覆盖率的目标。未报告严重不良事件。该研究的结果尚未以同行评审的形式发表。
另一种方法涉及将多巴胺产生细胞移植到大脑中。使用胎儿细胞用于此目的面临挑战,包括伦理问题和结果不一致,但干细胞疗法的最新发展为使用替代细胞来源生成多巴胺产生神经元用于移植提供了潜力。2024年阿尔茨海默病和帕金森病会议(AD/PD 2024)上展示的一项I期临床试验的初步发现表明,高剂量队列的参与者在18个月后显示出无麻烦异动症的“开”状态时间平均改善2.7小时。18个月后,“关”状态时间相应减少了2.7小时,并且在药物关闭状态下观察到运动障碍协会-统一PD评分量表(MDS-UPDRS)第III部分评分比基线减少了23.0分。低剂量队列的临床益处较为温和。15F-DOPA PET扫描提供了两个队列中细胞存活和植入的证据。尽管这些研究规模小且开放标签,但它们达到了安全性和耐受性的主要目标,并提供了临床结果改善的初步证据,代表了PD症状治疗发展的重要一步。管线中的其他策略包括一种个性化(自体)细胞疗法,称为ANPD001。
非运动症状,如直立性低血压,显著导致PD患者的残疾,多沙多巴已被FDA批准用于治疗这种情况。Ampreloxetine是一种选择性去甲肾上腺素再摄取抑制剂,也已测试用于此适应症,但数据尚不明确。抑郁和焦虑是与运动波动相关的最常见的非运动症状,治疗具有挑战性。Vortioxetine是一种新的5-羟色胺再摄取抑制剂,已显示出改善PD患者的抑郁症状和认知功能。此外,2023年AD/PD会议上报告的一项II期试验(尚未经过同行评审)显示,克伦特罗和纳多洛尔的组合在PD患者中产生了快速起效的认知和情绪改善。
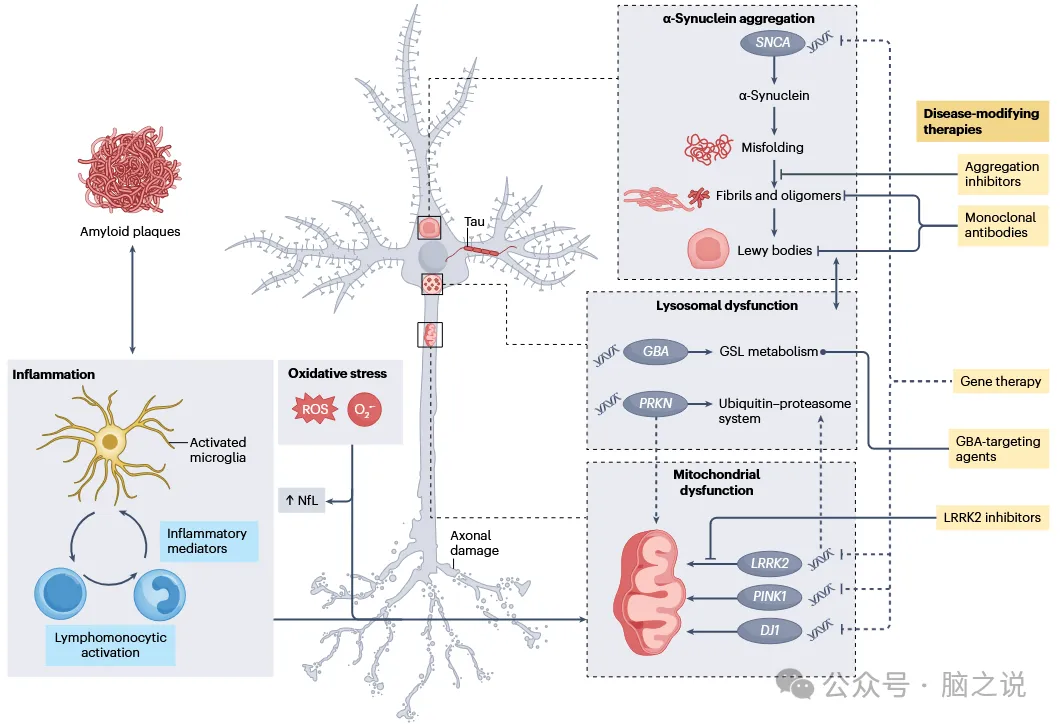
图1 帕金森病的病理生理机制及可能的疾病修饰疗法
3.2 疾病修饰疗法
在携带致病性基因突变的PD患者中,可以开发生物治疗来专门纠正与突变基因相关的酶缺陷。尽管估计只有10-15%的PD病例是由单基因突变引起的,但对疾病遗传基础的研究提供了基本的发病机制见解,并促进了针对常染色体显性和隐性形式的基因靶向治疗策略的发展。这些研究中出现的治疗目标如图1所示。
α-突触核蛋白靶向疗法:α-突触核蛋白是一种突触前蛋白,主要以单体形式存在,广泛分布于新皮质、海马、黑质、丘脑和小脑中。α-突触核蛋白由SNCA基因编码,该基因的突变和倍增与严重的PD形式相关。
在PD中,单体α-突触核蛋白倾向于错误折叠并聚集成寡聚体,最终稳定成更大的β-片结构并生成原纤维和淀粉样纤维。聚集的纤维可以在神经元胞体(路易体)中检测为球形嗜酸性包涵体,并且通过免疫组织化学染色,也可以在轴突和树突中检测到(路易神经突)。尽管α-突触核蛋白病理并非PD独有,但错误折叠蛋白的聚集和传播被认为是该疾病的主要病理基础之一。一些证据表明,α-突触核蛋白聚集过程可能始于外周组织,包括胃肠道和肠神经系统,一旦启动,就会通过类似朊病毒的机制逐渐涉及中脑、皮质和大脑的关联区域。
在寻找PD的DMTs过程中,正在追求多种直接或间接靶向α-突触核蛋白聚集的方法。使用靶向α-突触核蛋白的人抗体进行免疫治疗已显示出改善各种突触核蛋白病临床前模型的病理和行为缺陷。两项在初诊PD患者中进行的大规模被动免疫试验,SPARK(cinpanemab)和PASADENA(prasinezumab),未能达到其主要终点(MDS-UPDRS第II和III部分评分的变化)。在SPARK中,未达到任何次要终点,但在PASADENA中,观察到治疗患者运动进展较慢的趋势。PASADENA采用延迟启动设计,在第52周和104周时,早期启动组在MDS-UPDRS运动评分(第III部分)中显示出调整后的平均差异分别为-1.22(SE 1.08,80% CI -2.60至0.16)和-1.93(SE 1.66,80% CI -4.07至0.20),与延迟启动组相比。值得注意的是,数字运动评分在整个研究期间与MDS-UPDRS第III部分评分一致(斜率-治疗交互作用0.13,SE 0.067;P=0.049)。此外,探索性分析的结果表明,在1年的试验期间,prasinezumab在运动疾病更严重的个体中更大程度地减缓了运动进展。然而,鉴于该分析的事后性质,需要随机临床试验来证实这些结果。IIb期安慰剂对照的PADOVA研究(NCT04777331)最近完成了586名早期PD患者的入组。该研究的主要终点与PASADENA不同,即确认运动进展事件的时间。
SPARK和PASADENA在相似的人群中进行,具有相似的设计和终点。次要终点的不同结果可能由两种抗体的药理学特性解释。就结果测量而言,只有MDS-UPDRS的运动部分(第III部分)对检测疾病修饰敏感;第I部分(心理、行为和情绪)和第II部分(ADLs)评分的变化在轻度受影响人群中难以检测。在稍微更晚期的PD人群中可能会获得更清晰的结果。
其他几项靶向α-突触核蛋白的试验已经启动或正在进行。Minzasolmin是一种环状肽模拟化合物,设计用于与α-突触核蛋白C端结构域相互作用,并已优化为口服生物利用度和脑部进入。该化合物在体外和α-突触核蛋白转基因小鼠模型中减少了α-突触核蛋白聚集,并在后者模型中获得了在给药后1小时内皮质突触α-突触核蛋白减少的成像证据。Minzasolmin的I/II期研究显示出良好的耐受性,没有显著的安全性或耐受性问题,ORCHESTRA(NCT04658186)是一项大型IIb期试验,每天口服该药物在早期PD患者中,刚刚完成招募。
Buntanetap是一种口服生物可利用的小分子,抑制编码淀粉样前体蛋白、tau、α-突触核蛋白和其他神经毒性聚集蛋白的mRNA的翻译。该药物在PD患者中的II期研究(NCT05357989)已完成,但结果尚未公布。
Vodobatinib是一种强效、特异性的c-Abl激酶抑制剂,该酶与α-突触核蛋白诱导的神经退行性变有关。PROSEEK(NCT0365236)是一项II期安慰剂对照试验,评估口服vodobatinib在早期PD患者中的安全性和有效性,现已完成入组。
其他一些靶向α-突触核蛋白的方法正处于早期研究阶段。Toll样受体(TLR)信号传导是介导炎症的主要途径,特别是TLR2在PD中的作用越来越受到关注。PD患者大脑中神经元TLR2的表达显著增加,并且该受体强烈定位于α-突触核蛋白阳性的路易体。在细胞培养中,神经元TLR2的激活诱导了炎症反应,包括炎症细胞因子和小胶质细胞激活趋化因子的分泌,以及活性氧的产生。此外,神经元TLR2的激活增加了内源性α-突触核蛋白的水平,这反过来又与自噬-溶酶体途径标志物p62水平的增加相关,使TLR2成为PD治疗的潜在靶点。Tomaralimab是第一种针对TLR2的人源化IgG4单克隆抗体,旨在预防由不适当或过度激活的先天免疫途径驱动的炎症。到目前为止,该药物仅在健康个体中进行了I期研究,尽管计划在PD患者中进行II期研究。
Anle138b是一种通用的蛋白质聚集抑制剂,已显示出在体外阻断朊病毒蛋白和α-突触核蛋白的病理聚集。在朊病毒疾病小鼠模型和三种不同的PD小鼠模型中,anle138b强烈抑制寡聚体积累、神经元退化和疾病进展。Anle138b在治疗剂量下未检测到毒性,并在这些动物模型中显示出优异的口服生物利用度和血脑屏障穿透性。未来,anle138b或类似化合物可能是靶向不同蛋白质寡聚体的良好候选者。
Inzonellidis是一种NLRP3炎性体抑制剂,其激活被认为在PD中起关键致病作用。Inzonellidis可能减少α-突触核蛋白聚集,并处于早期开发阶段。
其他方法:LRRK2基因编码亮氨酸重复激酶2(LRRK2),其突变占白种人PD病例的2-7%,在阿什肯纳兹犹太人和北非人群中,高达40%的PD个体携带LRRK2 G2019S突变。LRRK2的多态性变体G2385R和R1628P在阿拉伯和亚洲人群中与PD风险增加相关。LRRK2突变导致激酶活性增加,药理学抑制该活性已在各种细胞和动物PD模型中显示出减少神经毒性。BIB122(也称为DNL151)是一种抑制LRRK2激酶活性的小分子,LUMA研究(NCT05348785)目前正在招募散发性或LRRK2相关PD患者来测试该药物。
GBA突变减少编码蛋白葡萄糖脑苷脂酶的酶活性,与路易体病理相关。BIA 28-6156是一种葡萄糖脑苷脂酶激活剂,正在开发为一种新型、首创药物化合物,用于潜在治疗GBA相关PD患者。该药物旨在增加葡萄糖脑苷脂酶活性并改善溶酶体中的糖脂代谢。临床前研究表明,BIA 28-6156易于穿过血脑屏障以进入大脑和中枢神经系统中的葡萄糖脑苷脂酶。BIA 28-6156的II期临床试验(NCT05819359)目前正在招募中。
一些主要作用机制不直接与α-突触核蛋白错误折叠和毒性相关的治疗药物可能对α-突触核蛋白途径有次要影响。例如,胰高血糖素样肽1受体激动剂主要靶向脑胰岛素抵抗,但也具有抗炎和神经营养特性,可以减轻α-突触核蛋白聚集。
4. 症状治疗的未来优先事项
尖端研究对于识别和测试新的化合物和策略以减轻PD负担至关重要。在本节和下一节中,我们提出了这项研究的路线图,重点关注两个主要优先事项:改善症状治疗策略和开发针对疾病机制的生物疗法。
无论当前的DMT试验结果如何,PD患者在未来许多年内仍将需要症状治疗。症状治疗仍然是改善患者生活质量和整体福祉的最可靠和可行的方法,无论潜在的疾病机制如何。在本节中,我们探讨了当前PD症状治疗的优先事项,并考虑了最新进展的可能影响。
4.1 运动波动和异动症
在过去的20年中,我们见证了PD治疗的显著改善,表现为出现麻烦运动并发症的患者数量减少。可能促成这种改善的因素包括使用较低的总日剂量左旋多巴、对年轻发病PD患者的关注增加,以及认识到女性比男性更容易发生运动并发症。
除了使用较小剂量的左旋多巴外,引入多巴胺激动剂、MAO-B和COMT抑制剂以及金刚烷胺也可能有助于最小化运动并发症。最有力的证据涉及多巴胺激动剂的早期使用及其在延迟运动并发症发作方面的疗效。然而,不幸的是,这些药物可能产生不良影响,特别是冲动控制障碍和嗜睡,这些影响明显与剂量相关,并在医学界和患者群体中引发了重大关注。开发具有不同多巴胺受体刺激特性的新型多巴胺激动剂,如tavapadon,以及具有创新给药方式的制剂,可能会减少不良事件,提高耐受性,并扩大这些药物在PD治疗中的使用。现有的多巴胺激动剂似乎不会减少左旋多巴引入后异动症的风险;相反,它们的益处在于延迟左旋多巴治疗的需求。然而,这种延迟以运动改善和生活质量为代价,使得在几年后必须添加左旋多巴。
关于COMT抑制剂在延迟运动并发症方面的疗效的数据不太令人信服,可能是因为这些药物需要精细调整左旋多巴的剂量和时间以实现持续的左旋多巴血浆水平。STRIDE-PD试验强调了这种调整的难度,特别是在PD的早期阶段。STRIDE-PD是一项前瞻性134周双盲试验,比较了747名PD患者开始左旋多巴治疗时使用左旋多巴-卡比多巴或左旋多巴-卡比多巴-恩他卡朋(每天四次,间隔3.5小时)的异动症发生风险。主要终点是异动症发作的时间。开始使用左旋多巴-卡比多巴-恩他卡朋治疗未能延迟异动症发作时间或减少异动症频率,与左旋多巴-卡比多巴相比。STRIDE-PD研究设计未考虑总多巴胺能负荷,接受左旋多巴-卡比多巴-恩他卡朋治疗的患者比接受左旋多巴-卡比多巴治疗的患者接受了更高剂量的左旋多巴。
治疗麻烦的异动症仍然是PD中未满足的主要需求,尽管最近一项II期试验的结果表明,多巴胺D3受体拮抗剂mesdopetam在不损害运动功能的情况下可以实现改善。金刚烷胺也显示出改善PD患者异动症的疗效。
总体而言,我们认为,由于新型COMT和MAO-B抑制剂的实施以及按需疗法(如舌下阿扑吗啡和吸入左旋多巴)的引入,过去几年中“关”时间的药物治疗有了显著改善。因此,我们预计未来几年在这一领域的进展有限,新口服药物的引入可能会面临相当大的障碍,例如腺苷A2拮抗剂的情况,该药物已在日本和美国上市,但被欧洲当局拒绝。
PD诊断的沟通、治疗开始的时间选择和症状药物治疗的选择都代表了PD旅程中的重要里程碑。这一协作决策过程需要涵盖患者期望和偏好的全面讨论,以确定最佳治疗方案。早期联合抗帕金森病药物治疗可能是有利的,使患者能够从多种药物的较低剂量中获益,而不是增加左旋多巴剂量。
当前PD的疾病标志物主要集中在黑质纹状体多巴胺能系统上,我们认为未来的药理学研究应关注其他神经递质和多巴胺抵抗症状,特别是针对5-羟色胺能、谷氨酸能和胆碱能途径的化合物。例如,5-HT1A和5-HT1B受体激动剂、NMDA和AMPA受体拮抗剂、mGluR5负性和mGluR4正性变构调节剂。乙酰胆碱和烟碱乙酰胆碱受体、阿片受体、内源性大麻素受体以及去甲肾上腺素能和肾上腺素能受体也可以作为潜在的治疗靶点进行探索。
4.2 设备辅助疗法
皮下左旋多巴-卡比多巴输注有可能通过允许24小时药物输送和夜间症状控制来显著改善PD的管理。然而,尽管这些疗法已经存在多年,但由于成本、耐受性和患者接受度,它们在常规临床实践中的使用受到限制。新的技术进步可能为左旋多巴的持续输送提供新的、侵入性较小的给药途径。例如,一种放置在口腔内并持续释放左旋多巴-卡比多巴的微泵装置已显示出确保相对稳定和持续的左旋多巴血浆水平,并可能在运动并发症发生之前部署。
正在进行的研究和技术进步继续推动DBS和其他神经调节方法的新方法和改进的发展。例如,定向电极的引入增强了对特定脑区的靶向,从而改善了症状控制,同时减少了不良影响。这些电极允许在多个方向上进行选择性刺激,从而实现更精确的神经回路调节。
在未来几年中,闭环和自适应DBS系统的实施预计将代表PD治疗的重要进展。当前的DBS系统以开环方式运行,即电刺激连续或以预编程的间隔提供。相比之下,闭环或自适应DBS系统根据神经元活动的实时反馈调整其刺激参数,从而提供更精确和个性化的治疗。更具体地说,自适应DBS系统根据代表症状或运动或行为特征的输入信号调整其刺激参数。这些系统需要复杂的算法,根据个体患者反应、独特神经活动的检测以及症状波动提供刺激,并应进一步改善治疗效果。
识别左旋多巴无反应症状的新刺激靶点是当前和未来研究的另一个重要优先事项。例如,一项正在进行的研究正在探索在PD和痴呆患者中联合刺激丘脑底核和Meynert基底核。
5. 疾病修饰的未来优先事项
开发旨在改变PD进展的策略需要对潜在病理和遗传学的详细了解,并在实施干预措施之前对个体患者进行表征。这种方法要求很高,最好在运动表现出现之前或之后立即实施。尽管在阐明PD的病理生理学方面取得了进展,但将这些知识转化为临床实践仍面临重大障碍。在本节中,我们提出了一种务实的DMT开发方法,重点关注诊断和进展生物标志物以及遗传学的作用。
5.1 一级预防
目前没有明确的策略可以预防PD。在风险人群中,如遗传易感个体,环境因素(例如农药或工业污染)可能显著促进疾病的发展。相反,摄入咖啡因和尼古丁等化合物以及生活方式改变(如饮食和体育锻炼)可以降低患PD的风险。基因筛查以识别可能增加PD风险的突变可能有助于PD预防,尽管在尚无DMTs的疾病背景下,早期检测风险因素或疾病标志物引发了伦理和法律问题。然而,通过有针对性的教育提高人群意识可能会鼓励人们在未来寻求参与自愿筛查计划,并促进采用更健康的生活方式,无论风险因素如何,这可能会减少患PD的机会。
5.2 筛查和早期疾病检测:生物标志物的作用
PD的DMT开发过程需要允许早期疾病检测(可能在症状前阶段)并对疾病进展敏感的生物标志物(框1)。当前PD的诊断标准主要依赖于主要运动症状的表现,即运动迟缓、强直和静止性震颤,并通过PET和单光子发射CT(SPECT)结果提高不确定病例的准确性。然而,运动表现仅在50-60%的多巴胺能神经元丢失时发生,此时疾病修饰的可能性严重受限。许多症状前症状,如便秘、抑郁、REM睡眠行为障碍和嗅觉减退,可能在运动表现之前发生,但它们是非特异性的,仍需要经过验证的生物标志物来支持诊断。流行病学研究出现的风险因素可以帮助选择生物标志物验证的人群。
识别和利用可靠的疾病特异性生物标志物具有双重优势。首先,它能够更早地检测PD,从而优化治疗途径并促进早期疾病监测。其次,它简化了针对实验药物特定作用机制的新生物测定方法的开发。然而,α-突触核蛋白相关疾病的临床前检测可能引发法律和伦理问题,特别是在目前无法治疗的疾病(如多系统萎缩(MSA))的情况下。
尽管生物标志物的发现和验证最初需要大量的财政和人力资源,但开发安全、易于执行的生物标志物检测方法——例如使用血液或唾液样本——将允许以经济高效的方式筛查大规模人群。一旦验证了个体生物标志物或生物标志物组合,可以提出筛查活动,类似于现有的结直肠癌、乳腺癌和前列腺癌筛查计划。筛查标准应考虑年龄、PD家族史和REM睡眠行为障碍的存在等变量,并可能包括预测风险个体运动症状发展的特定因素。
针对普通人群,特别是PD风险人群的教育计划可能在鼓励个人参与筛查计划中发挥关键作用。PD的早期阶段通常以微妙的运动前表现为特征,这些表现可能被忽视或被误认为无关问题。通过提高对这些症状及其与疾病过程潜在联系的认识,个人可能会积极寻求早期筛查机会。如果开发出有效的DMTs,早期检测可能特别有价值,以便及时参与治疗计划。在接下来的部分中,我们概述了正在开发和验证的生物标志物,包括生物流体、外周组织、成像和数字标志物。
在PD患者的生物流体中,特别是脑脊液(CSF)和血液中,已经研究了几种潜在的退化标志物。这些标志物包括α-突触核蛋白、神经丝轻链(NfL)、溶酶体标志物、炎症标志物和微小RNA等。与其他可能受外周和肠神经系统损伤影响的生物流体相比,CSF标志物可能更具体地反映中枢神经系统的变化。然而,发现总α-突触核蛋白的CSF水平在其他突触核蛋白病和tau蛋白病中升高,降低了诊断特异性。磷酸化α-突触核蛋白水平在PD患者的CSF中也升高,但与疾病进展的关系仍不确定。CSF中寡聚或磷酸化α-突触核蛋白与总α-突触核蛋白的比率显示出比单独测量更好的诊断准确性、敏感性和特异性,用于区分PD患者与健康或神经病学对照。
α-突触核蛋白种子扩增测定(SAA),如实时震动诱导转化(RT-QuIC),是定性测定,可以检测生物流体和组织样本中的α-突触核蛋白病理。CSF和皮肤SAA在症状前PD队列中检测到α-突触核蛋白病理,表明它们可以提供相对简单的筛查工具,以识别将从α-突触核蛋白靶向治疗中受益的患者。重要的是,两篇出版物报道,RT-QuIC在血清样本上可以区分突触核蛋白病患者与对照。在另一项研究中,SAA能够在临床诊断PD前10年检测到血液中的病理性α-突触核蛋白聚集体,进一步支持血液生物标志物可能有助于在PD症状前阶段实施DMTs的观点。
NfL是仅在神经元中表达的神经丝亚基,作为神经退行性变的非特异性标志物受到了相当大的关注。在进展性核上性麻痹、MSA或PD患者的CSF中报告了NfL水平升高,较高水平表示更严重的病情。NfL水平也在PD或MSA患者的血清中进行了评估;然而,血清检测对评估中枢神经系统神经退行性变的具体性需要在包括年龄匹配对照人群的研究中进一步调查。
溶酶体生物标志物可能是一个有前途的研究方向,因为溶酶体代谢的改变与PD的病理生理学有关,并且可以在生物流体中测量。在PD或路易体痴呆患者的CSF中证明了溶酶体酶葡萄糖脑苷脂酶活性降低;这种降低在GBA突变携带者中尤为明显,可能反映了更激进的神经病理过程。中枢神经系统来源的外泌体含有α-突触核蛋白,也与PD患者血浆中高水平的α-突触核蛋白相关。溶酶体疾病进展标志物值得进一步研究,可能作为涵盖一系列病理途径的生物标志物组合的一部分。
炎症生物标志物水平,如肿瘤坏死因子、IL-4、IL-6和IL-10,在PD患者的CSF和血液中升高。一项研究表明,PD患者血液和CSF中IL-8、α-突触核蛋白、淀粉样β1-42和淀粉样β1-40的组合允许测量疾病进展中的炎症水平。
微小RNA是参与基因调控的小非编码RNA,并已涉及中枢神经系统的突触发育和成熟。在PD患者中发现了几种微小RNA异常表达,并被认为在疾病发作和进展中起作用。需要进一步的研究来验证特定的微小RNA组合是否可以在PD中提供足够的诊断准确性。
检测外周组织中的α-突触核蛋白沉积的兴趣日益增加,包括胃肠道和皮肤。由于这些组织可以通过微创程序在体内取样,外周组织活检正在成为突触核蛋白病的潜在诊断工具。
外周组织的SAA具有高灵敏度和特异性,但仅是定性的,不允许病理沉积的解剖定位,并且对疾病进展不敏感。因此,免疫组织化学仍然是检测磷酸化和聚集α-突触核蛋白的金标准方法,尽管尚未就外周组织中使用的最佳抗体达成共识。在一系列组织中检测到病理性α-突触核蛋白,包括皮肤、嗅觉粘膜和唾液腺。使用针对磷酸化α-突触核蛋白pS129物种的抗体对皮肤样本进行的免疫组织化学显示,与对照相比,PD患者的染色增加,特别是如果活检取自腹部或头皮。在包括PD患者的异质队列中,对天然α-突触核蛋白、pS129 α-突触核蛋白和成熟α-突触核蛋白纤维的表征显示,pS129 α-突触核蛋白在检测皮肤神经中的α-突触核蛋白沉积以及基于α-突触核蛋白定位区分突触核蛋白病方面具有最高的灵敏度。
关于胃肠道,在十二指肠和结肠粘膜活检的神经纤维中发现了聚集的α-突触核蛋白沉积。这些发现在尸检样本中得到证实,尽管其他体内研究报告了异质性染色模式,可能是由于方法学差异。考虑到肠神经系统在PD症状前阶段,特别是与便秘(症状前阶段的常见症状)相关的可能作用,检测肠粘膜中的α-突触核蛋白聚集和沉积具有相当大的相关性。
综上所述,迄今为止的研究结果支持进一步探索磷酸化和聚集的α-突触核蛋白及其在外周组织神经结构中的特定沉积作为PD的潜在生物标志物。
多巴胺转运体(DAT)成像与SPECT在区分退行性和非退行性帕金森综合征方面具有超过90%的灵敏度和特异性;然而,它对PD并不特异,因为纹状体DAT丢失是影响基底节疾病的常见特征。选择性纹状体DAT放射性配体11C-PE2I在检测早期至中度PD患者运动严重程度差异方面显示出高预测价值和灵敏度,表明该示踪剂可以提供客观的生物标志物,以研究新型干预措施对黑质纹状体退化速率的影响。DAT SPECT成像也被认为是疾病修饰临床试验(包括最近的免疫疗法研究)中的替代进展生物标志物,尽管与阿尔茨海默病中的淀粉样成像不同,信号变化并不反映病理。神经黑色素MRI是另一种诊断成像工具,可能通过揭示nigrosome 1信号的丢失(燕尾征)早期识别PD患者。
体内识别病理性α-突触核蛋白聚集体对于证明PD DMTs试验中的靶点参与非常重要。体内检测PD中的α-突触核蛋白病理具有挑战性,但正在取得一些进展。PET示踪剂18F-ACI-12589显示出与MSA患者病理性α-突触核蛋白分布匹配的特定信号。此外,小分子PET放射性配体18F-C05-05与α-突触核蛋白结合,在PD患者中产生比健康对照更强烈的中脑信号,提供了该条件下α-突触核蛋白成像的首次演示。
最后,超高场MRI的出现提高了可靠评估脑干结构(如延髓核)疾病相关改变的可能性。
数字健康技术涵盖广泛的技术应用,可用于远程监测PD患者,包括以手表、手环或衣物形式佩戴在身体上的设备、智能手机、嵌入患者家中的传感器(例如智能床)以及常用设备如电脑键盘。理想情况下,这些设备不应干扰个人的正常生活方式。详细讨论可用技术和传感器超出了本综述的范围,但我们认为数字技术提供了筛查大规模人群以识别需要进一步临床评估和生物流体筛查的个体的机会。大多数正在进行的疾病修饰试验包括使用可穿戴传感器,允许评估长期监测的可行性以及探索性疗效指标。数字技术还可以允许在家中或社区中提供护理,从而限制治疗优化所需的医院访问。
5.3 组合和个性化方法用于疾病修饰
在开发疾病修饰策略时,PD领域可以从其他领域(如肿瘤学和传染病)的组合疗法中学习,这些领域已经显著改善了临床结果。PD是一种临床异质性疾病,具有多种可能相互作用的机制,可能需要结合不同的方法来有效应对。例如,用于治疗糖尿病的胰高血糖素样肽1受体激动剂在PD患者中显示出潜力,突显了脑胰岛素信号传导和胰岛素受体在该疾病中的潜在作用。探索组合疗法的可行性并设计创新试验来测试这些策略是PD研究的重要未来优先事项。
单一药物可能无法有效应对大脑或外周中的错误折叠α-突触核蛋白,可能需要药物组合来针对疾病过程中的不同靶点。例如,α-突触核蛋白抗体可以作用于大脑中的蛋白质聚集体,并可以与防止进一步α-突触核蛋白聚集的药物(例如minzasolmin、inzonellid或buntanetap)或预防或减少炎症的药物(例如tomaralimab)结合,前提是这些药物的持续研究产生积极结果。此外,抗α-突触核蛋白疗法可以与针对其他神经退行性变病理过程的疗法结合,例如tau聚集。这种“鸡尾酒”方法可以包括不同的抗体或免疫疗法和酶调节剂的组合,例如针对GBA突变的患者。
同样的推理也适用于患者间的异质性:单一疗法不会对每个患者都有效,但组合疗法可能提供临床上有意义的反应机会,前提是通过实施遗传和生物标志物正确定义潜在病理。此外,基于运动严重程度对患者进行分层可能有助于检测反应者,并为免疫疗法提供更有效的纳入标准。
一些治疗策略即使对神经退行性变没有直接影响,也可能被认为是疾病修饰。例如,通过恢复或加强在临床症状出现时可能失效的代偿机制,可能可以“逆转”一些临床特征,而无需改变潜在疾病,例如通过生活方式改变,包括更规律的体育活动或强化训练。
尽管改变PD进展仍然是一个核心目标,但管理症状、减轻残疾和改善日常功能的干预措施,包括手术或输注设备辅助疗法,可以对患者结果产生深远影响。此外,通过采取务实的立场,强调使用已证明可以减轻残疾和改善生活质量的疗法,临床医生可以制定符合每个PD患者独特需求和偏好的治疗计划。这种个性化方法不仅使患者能够积极参与他们的护理,还促进了医疗保健提供者和患者之间的治疗联盟。
6. 结论
近年来,针对PD潜在原因和机制的深入研究有所加强。鉴于正在进行和即将进行的临床试验数量众多,我们预计将取得积极成果,可能导致新型DMTs的批准。
我们即将验证用于PD早期诊断的敏感生物标志物,但我们缺乏目标参与和疾病修饰的指标,这些指标目前通过临床运动结果间接测量。鉴于运动评估量表的变异性和局限性,我们鼓励当局和研究人员验证可穿戴传感器以提供结果测量。在更晚期的阶段,生活质量、事件时间(进展里程碑)和ADL也应被考虑。
在未来几年中,生物流体检测可能使对潜在PD风险个体(例如表现出疾病前驱症状的个体)进行人群筛查成为可能。然后可以实施确认性测试,采用免疫组织化学、RT-QuIC和/或分子成像(PET或SPECT扫描)等技术。基因筛查可以提供一种补充方法,将患者分配到最合适的疾病修饰策略。
症状治疗预计将在未来许多年内仍然是PD管理的基石。在这种情况下,研究重点应解决对左旋多巴反应不佳的症状的预防和治疗,包括运动波动和异动症、认知功能障碍以及平衡和步态障碍。这一目标可以通过改进药物输送、开发创新的多巴胺激动剂和靶向非多巴胺能途径来实现,并应探索组合方法以满足个体患者在不同疾病阶段的具体需求。
参考文献:Parkinson disease therapy:current strategies and future research priorities.
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。

