文献分享--人类和小鼠肺腺癌前体的空间和多组学分析揭示TIM-3作为癌前拦截的假定靶点
原创文献分享--人类和小鼠肺腺癌前体的空间和多组学分析揭示TIM-3作为癌前拦截的假定靶点
原创
追风少年i
发布于 2025-06-23 16:13:34
发布于 2025-06-23 16:13:34
作者,Evil Genius
今天我们分享文献,作者全是中国人,然而是美国的单位。

知识积累
随着LUAD前体的进展,适应性反应逐渐增加,先天性免疫反应相对减少。
了解早期肺癌发生的分子机制对于精确的筛查、诊断、预防和治疗至关重要。
在LUAD前体中,非典型腺瘤样增生(AAH)是唯一公认的LUAD癌前病变,有可能进展为浸润前原位腺癌(AIS)、微创腺癌(MIA)和最终的明显浸润性LUAD(IAC)。这些LUAD前体通常表现为磨玻璃样阴影(GGO)为主的肺结节。
先前的研究揭示了随着AAH向AIS、MIA和侵袭性LUAD进展,基因组和甲基化复杂性逐渐升级。此外,注意到晚期病变中的免疫库活性较低且调节更严格,表明肿瘤进展期间正在进行“免疫编辑"。
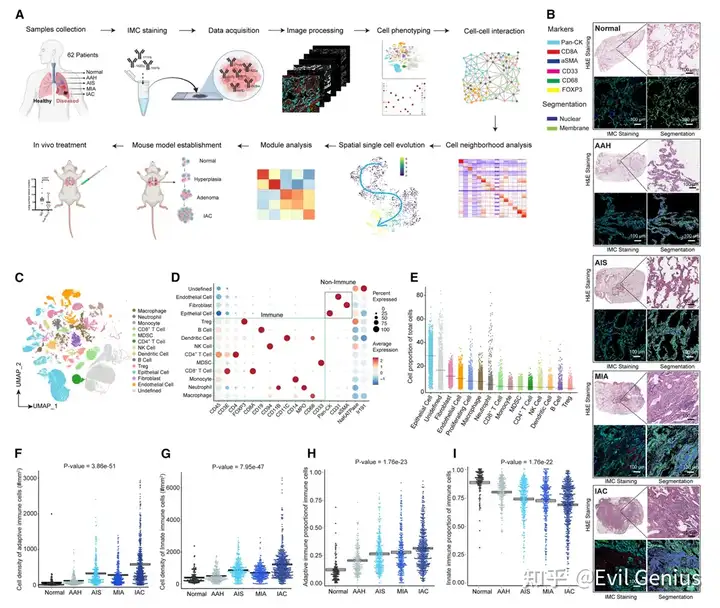
结果一、LUAD前体进展与先天免疫和适应性免疫之间的协调有关(IMC)
首先是细胞图谱。
LUAD早期癌变过程中伴有巨噬细胞极化和T淋巴细胞功能分化
从AAH到AIS、MIA、IAC,巨噬细胞密度逐渐增加,但比例变化趋势不明显。
考虑到M1的抗肿瘤功能和M2巨噬细胞的促肿瘤功能,后期M2/M1比率增加表明在LUAD前体进展期间与巨噬细胞极化相关的免疫抑制进展。
在抗肿瘤免疫中发挥核心作用的T淋巴细胞中,CD4+ T细胞被分为幼稚、记忆、增殖、耗竭的CD4+ T细胞和Tregs。所有五种CD4+ T细胞亚型的密度随着肿瘤从AAH进展到AIS、MIA和IAC而增加,这与晚期病变中适应性免疫细胞的总体较高浸润一致。
在抗原暴露和LUAD前体进展时,初始T淋巴细胞持续分化为不同的功能性T细胞亚群。
结果二、从肺癌前病变到浸润性LUAD,上皮细胞与成纤维细胞、Tregs和巨噬细胞的共定位增加
量化了细胞共定位以推断主要细胞类型之间的细胞间“相互作用"或”avoidance"。
上皮细胞倾向于与其他上皮细胞共定位,这与“同型相互作用”--与相同细胞类型共定位相一致。在浸润性肺癌和乳腺癌中也报道了类似的模式,这表明恶性和癌前细胞可能相互交流,以修改它们的TME,并创造一个支持它们生长的促肿瘤生态位。
在不同细胞类型之间的异型相互作用-共定位中,上皮细胞和成纤维细胞之间的相互作用是最强的,与成纤维细胞可以形成保护性纤维化屏障对抗免疫攻击的报道一致。重要的是,这些异型相互作用在晚期病变中增加,表明随着肿瘤演变,TME内肿瘤细胞生长的基质支持增加。主要免疫细胞之间的同型相互作用沿着肿瘤进展而增加,表明肿瘤演变期间TME中相同细胞类型之间的空间协调免疫应答。TME和上皮细胞之间的相互作用从正常肺组织中的回避转变为IAC阶段的相互作用,这表明在晚期疾病中增加了对免疫抑制性TME的免疫调节。
随着LUAD前体的进展,上皮细胞和巨噬细胞之间的异型相互作用也增加。上皮细胞和M1与M2巨噬细胞之间的相互作用不同。总体而言,在不同的组织学阶段,M2与上皮细胞的异型相互作用高于M1,特别是在与其促肿瘤功能一致的晚期。此外,在晚期LUAD前体中,M2和DC之间的异型相互作用也增加,这表明抗肿瘤免疫的负控制沿着肿瘤进展而增加,因为M2巨噬细胞可以抑制DC的抗原呈递能力,随后损害CD8+ T细胞应答。
细胞邻域分析突出了早期LUAD癌变过程中免疫细胞的募集和组织
基于每个细胞的十个最近的空间邻居定义了8个细胞邻域(CN),以进一步描绘LUAD前体的多细胞TME架构。值得注意的是,免疫细胞富集的CN 8(富集T淋巴细胞、CD8+、CD4+ T细胞、NK细胞、嗜中性粒细胞、B细胞、DC、单核细胞和MDSC)的密度在晚期病变中逐渐增加,再次表明通过募集各种免疫细胞来阻碍癌症进展而增加宿主免疫压力。
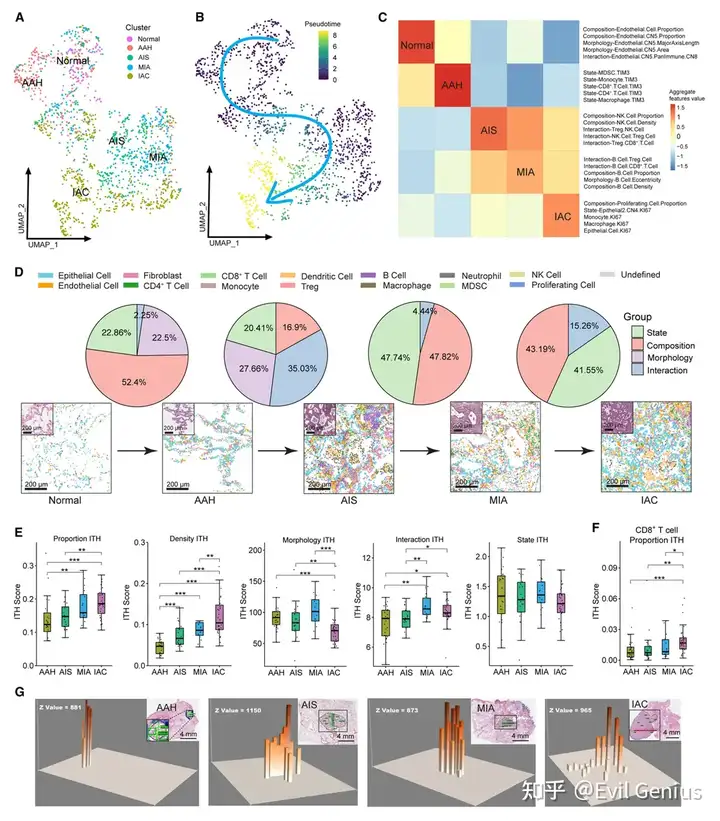
不同时期的LUAD前体具有不同的多细胞TME模块
为了全面阐明细胞组成、细胞组织和多细胞TME结构之间的相互作用,将上述衍生的细胞类型(CT)和CN分为四类:(1)CT/CN组成;(2)CT/CN相互作用;(3)CT/CN状态;(4)CT/CN形态。
Monocle 3分析证实了从正常肺组织开始并通过AAH、AIS、MIA进展,最终达到IAC阶段的总体轨迹。
接下来,使用特征共表达分析,建立了五个不同的多细胞空间模块,在每个组织学阶段丰富。
正常组织富含模块1(内皮参数富集模块),反映了内皮细胞(EC)在肺泡气体交换中的作用。
AAH阶段为模块2进行了富集(TIM-3富集模块),其特征在于细胞状态特征,尤其是在MDSC、巨噬细胞、CD 4+和CD 8 + T细胞上具有TIM-3高表达的特征。这些观察结果强调了在该阶段先天免疫和适应性免疫的协调,并表明TIM-3在LUAD癌前阶段的重要作用。
AIS阶段富集模块3(NK-Treg富集模块)。在AIS期,TCLs与NK细胞、细胞毒性T细胞、MDSC、DC和巨噬细胞表现出高度的异型相互作用,强调了TCLs的重要作用。MIA期富集了模块4(B细胞富集模块)。值得注意的是,B细胞的同型相互作用高度富集,B细胞与其他免疫细胞、上皮细胞和基质细胞的异型相互作用在MIA期也很普遍。最后,通过模块5(KI-67参数富集模块)对IAC进行了表征,强调了细胞增殖失控在侵袭性LUAD中的重要性,此外,与其他阶段相比,与免疫检查点分子和共刺激/共抑制免疫调节蛋白B7-H3(CD 276)相关的特征在IAC阶段也高度富集。
不同的TME组织特征构成了从正常到AAH、AIS、MIA和侵袭性LUAD的转变
比较这些特征(CT/CN状态、组成、形态和相互作用)在从正常肺到AAH、AIS、MIA和IAC的转变中如何变化。
结果表明,在正常肺组织向AAH的转化过程中,组成特征占52.4%,状态特征占22.86%,形态特征占22.5%,表明细胞比例、密度、状态和形态的改变是癌前病变发生过程中最显著的变化,相互作用特征仅占2.25%,表明在这两个阶段细胞通讯的变化很小。
随着AAH进展为AIS,相互作用特征增加到35.03%并成为主导,表明在此过渡期细胞通讯增加。其次是形态学特征增加到27.66%,与组织学变化一致。此过渡期与细胞比例和组成的较小变化(16%)相关。在AIS向MIA的过渡阶段,状态特征和成分特征再次占主导地位,分别占47.74%和47.82%,最后在MIA向IAC的过渡阶段,状态特征占主导地位(41.55%)和组成特征(43.19%)继续起主要作用,而相互作用特征占15.26%。值得注意的是,从正常肺到AAH、AIS和MIA,形态学特征的贡献显著,但随着LUAD发展到IAC,他们的贡献减少了。
LUAD癌前进展与TME肿瘤内异质性的进行性增加相关
肿瘤异质性是癌症的基本特征,对癌症的诊断、治疗和预后具有重要意义。
肿瘤内异质性(ITH)出现在癌前阶段。
评估不同阶段LUAD前体的多细胞空间组织的ITH。
通过ROI的成对比较中相应属性的平均欧几里得距离来量化细胞密度、细胞比例、细胞形态、细胞状态和细胞相互作用的ITH。
总体细胞形态ITH在AAH、AIS和MIA之间没有显著差异,但在IAC阶段显著降低,表明细胞形态在侵袭性LUAD阶段收敛。另一方面,细胞密度ITH和比例ITH随着肿瘤进展而增加,对于总体免疫浸润和单个免疫细胞类型,表明TME更复杂和异质,这可能在后期进一步损害抗肿瘤免疫。
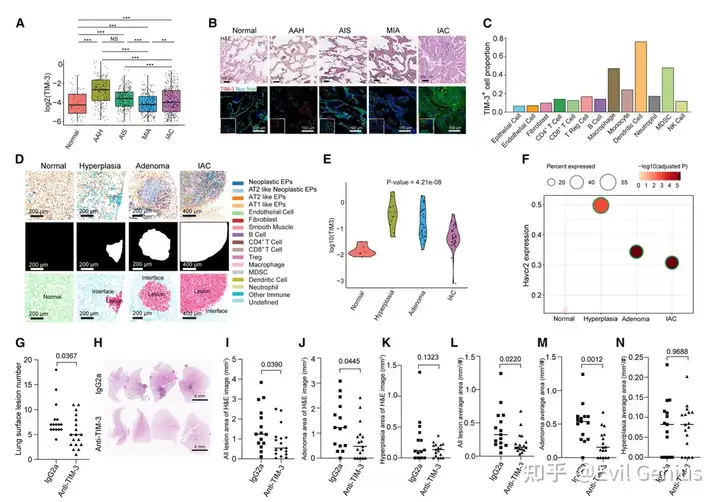
结果4、在人LUAD和小鼠模型中,TIM-3表达在癌变早期阶段增加
研究的一个重要目标是鉴定LUAD癌前拦截的新靶标,所以深入研究TIM-3,因为:(1)TIM-3高特征在AAH阶段富集,使其成为癌前拦截的有吸引力的靶标;和(2)多种抗TIM-3药物在临床试验中显示出良好的安全性,这对拦截/预防研究至关重要。与AAH阶段先天免疫细胞的高浸润一致,在包括DC、巨噬细胞和MDSC的各种先天免疫细胞中观察到最高TIM-3表达。此外,尽管在不同细胞类型的晚期病变中总体上更高的细胞密度,但TIM-3+巨噬细胞、DC和MDSC的绝对数量在AAH或AIS阶段达到峰值,突出了其在LUAD癌变早期阶段的关键作用。
基因工程小鼠验证。
TIM-3的上调可能是一个重要的免疫逃避机制,在早期LUAD癌变,这是保守的人类和小鼠LUAD的各种遗传背景和病因。
Ceacam 1可能通过与TIM-3结合介导LUAD癌前阶段的免疫逃避
空间转录组学和scRNA-seq数据,以确定与TIM-3相互作用的潜在配体,这些配体在早期LUAD癌变过程中介导免疫逃避。
在早期LUAD癌变过程中上皮细胞和先天免疫细胞之间存在显著的Ceacam 1-Havcr 2相互作用。
在癌前阶段阻断TIM-3可减弱肿瘤进展
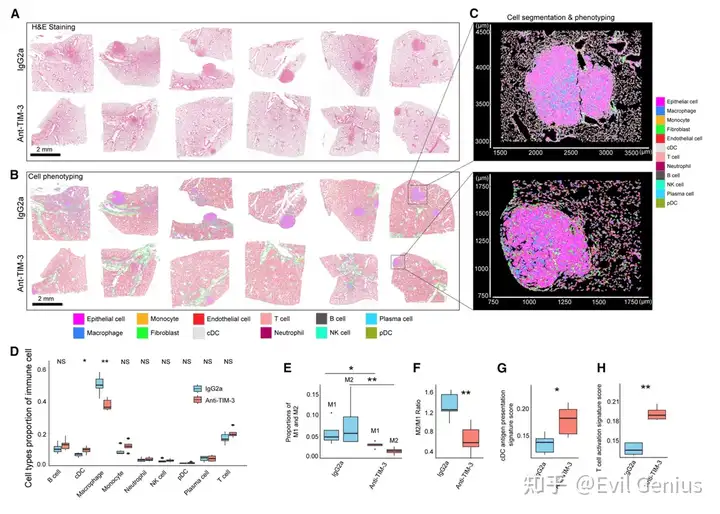
结果5、TIM-3阻断增强抗原呈递和免疫介导的细胞杀伤
Xenium 5 K空间转录组学分析。
总的来说,这些发现表明TIM-3阻断可以通过改善抗原呈递(增加抗原呈递cDC的比例和其增强的抗原呈递能力);通过增强经由T细胞的免疫介导的细胞杀伤(增加T细胞活化),以及通过M1/M2巨噬细胞比率向抗肿瘤活性的有利转变来增强抗肿瘤免疫。
最后,我们来看看方法
IMC的数据分析


轨迹分析


生活很好,有你更好
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
评论
登录后参与评论
推荐阅读
目录

