文献分享--病灶修复过程中心脏免疫微环境的时空动态变化
原创文献分享--病灶修复过程中心脏免疫微环境的时空动态变化
原创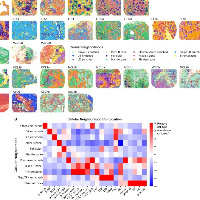
追风少年i
发布于 2025-11-17 11:04:51
发布于 2025-11-17 11:04:51
作者,Evil Genius
有人拿到HD的细胞分割数据、或者Xenium数据,想跟单细胞数据一样直接定义,目前来讲这种方式仍然可行度不高,原因也很简单,基因数量严重不足,达不到单细胞的水准,从看到的文章来看,借助单细胞的力量注释仍然是主流。
关于HD的数据分析,目前仍然建议采用双pattern的模式进行分析。
今天我们分享文献

知识积累
心肌梗死是全球首要致死原因,占死亡总数的16%。由于成年心脏再生能力有限,心梗患者常出现心输出量受损。不足1%的成年人心肌细胞具有增殖能力。
纤维化疤痕形成涉及多种细胞类型构成的复杂时程通信网络。心梗后,髓系细胞浸润组织,分泌白细胞介素-6、IL-1β和肿瘤坏死因子等促炎因子,并清除损伤区域的坏死心肌。Ly6CʰⁱᵍʰCCR2ʰⁱᵍʰ单核来源巨噬细胞从促炎状态转变为促修复状态,激活成纤维细胞向肌成纤维细胞的转化。肌成纤维细胞迁移至缺血区沉积细胞外基质蛋白,形成纤维化疤痕。虽然疤痕组织对伤口闭合和机械稳定性至关重要,但过度纤维化会导致电传导障碍、射血功能降低及心力衰竭。
单细胞RNA测序与高分辨率空间转录组技术。推断了创伤愈合主要阶段(早期炎症、疤痕形成与成熟期)中细胞状态及组织结构的动态变化。单细胞空间分辨率揭示了病灶微环境组成,呈现了疤痕形成过程中的局部细胞状态依赖性及信号交互。
发现在愈合后期存在动态的巨噬细胞-成纤维细胞互作,该机制可能防止过度纤维化。
结果1、单细胞分辨率下心脏疤痕形成的时空图谱
通过NiCo算法将单细胞的细胞类型数据转移至空间数据完成细胞类型注释。
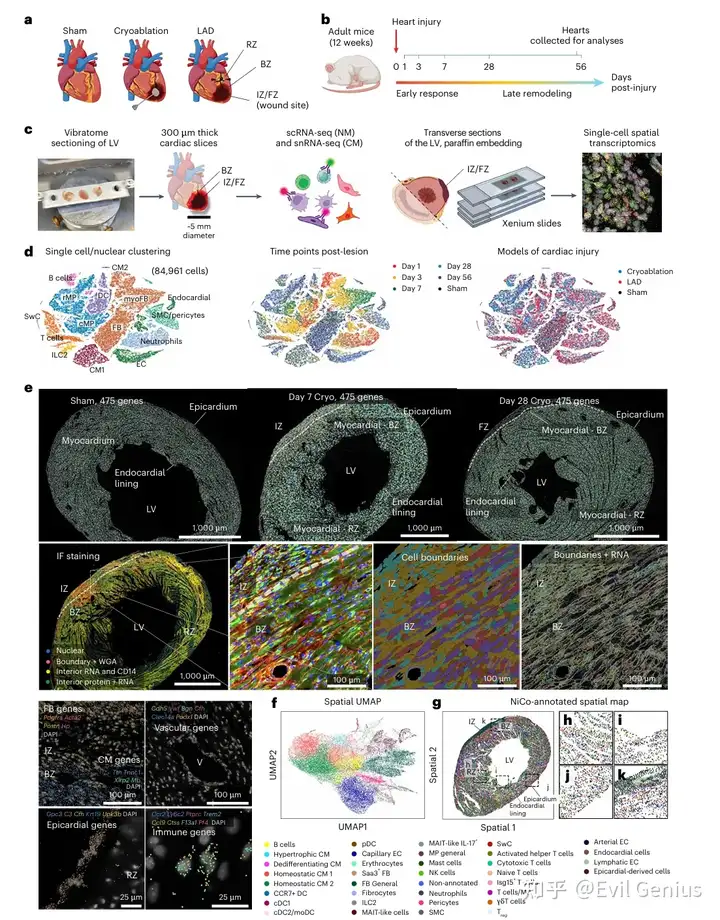
结果2、疤痕形成过程中的免疫细胞群动态波动
中性粒细胞、巨噬细胞、树突状细胞和肥大细胞在内的大部分髓系细胞在1-7天高度富集。
NiCo算法在空间模态中成功识别所有主要免疫细胞群。免疫组分以巨噬细胞为主,第7天定位于缺血区,而第28天全局免疫细胞密度降低。
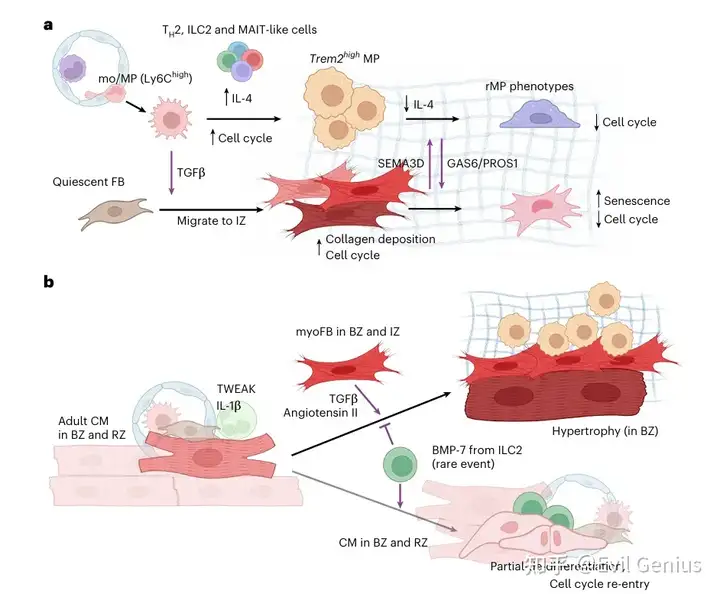
与既往研究一致,第7天病灶区以Spp1⁺单核/巨噬细胞和Trem2ʰⁱᵍʰ巨噬细胞为主,而第28天Cx3cr1ʰⁱᵍʰ巨噬细胞更显著。拟时序分析提示这些状态存在连续分化路径:从Ly6Cʰⁱᵍʰ/ᵐⁱᵈ与Spp1ʰⁱᵍʰ循环巨噬细胞状态,经第7天富集的Trem2ʰⁱᵍʰ过渡状态,最终转化为Cx3cr1ʰⁱᵍʰ定居巨噬细胞状态。值得注意的是,循环巨噬细胞在组织浸润后(1-3天)经历活跃增殖,第7天被抑制;而定居巨噬细胞的增殖活性始终稳定。修复中后期循环巨噬细胞数量减少可归因于细胞周期抑制及向定居巨噬表型转化,后者群体的扩增主要源于此转化过程。
淋巴细胞在时间和空间上的动态变化规律
早期响应:在损伤后第1天,一些非常规的、功能尚不明确的淋巴细胞(如ILC2、γδT、MAIT样细胞)率先被激活并出现在损伤区域。
峰值扩增:主要的淋巴细胞群(包括常规T细胞等)在损伤后第7天到第28天之间达到数量高峰。
后期消退:到修复后期(第28天),大部分淋巴细胞从核心的纤维化疤痕区域被清除。
空间动态:区域特异性分布
损伤核心区(IZ/FZ):在修复早期(第7天),T细胞(包括具有抑制免疫反应功能的调节性T细胞)可以浸润到损伤核心,并与淋巴管结构共存,暗示了其招募途径。到了后期(第28天),该区域的淋巴细胞大部分消失。
损伤周边及远端区域(BZ/RZ):淋巴细胞在修复后期更倾向于滞留或分布在损伤区域的外围和更远端的健康组织中。
研究发现了一些在心脏修复中角色未知的淋巴细胞亚群,提示免疫调控网络可能比已知的更为复杂。
调节性T细胞在损伤核心的出现,以及淋巴细胞与淋巴管的 spatial 关联,都强烈暗示淋巴细胞通过精确的招募和局部免疫调节机制,深度参与了心脏修复的微环境调控。
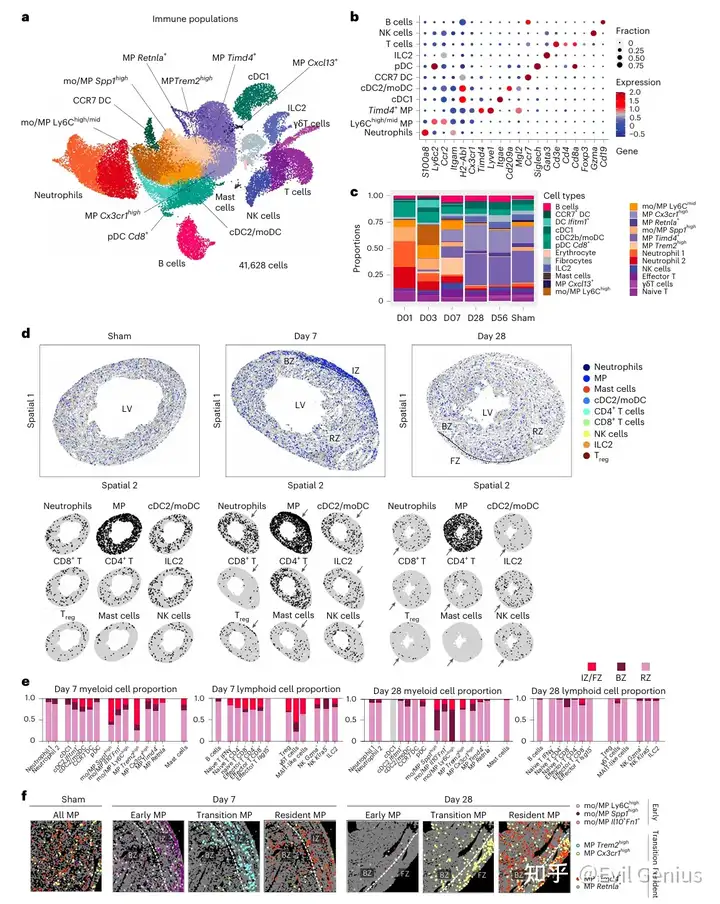
结果3、成纤维细胞、血管细胞和施万细胞的动态变化及其相互作用
成纤维细胞的动态转化:
经历从早期促炎(Ccl2⁺)到活化/增殖(肌成纤维细胞,多种功能亚型),最终向成熟/静息(基质纤维细胞、静息成纤维细胞)表型的有序转化。
不同功能亚型的肌成纤维细胞(如抗原呈递的IFN⁺亚型、分泌胶原的亚型)在损伤区域内(缺血区/纤维化区)外(边界区)存在空间分布差异,表明其功能受局部微环境精密调控。
血管系统的响应与重塑:
损伤早期,血管细胞(内皮细胞、周细胞)出现干扰素响应和增殖状态,主要位于损伤周边区域。
修复后期,血管系统趋于静息,并伴随持续的血管生成和淋巴管生成,以建立和维持疤痕区域的循环。
施万细胞的意外作用:
作为神经细胞,施万细胞在损伤后表现出瞬时激活,并经历了从早期激活(半乳糖凝集素⁺)到干扰素响应(IFN⁺)的状态转变。
其激活状态在时空上与血管细胞的干扰素响应重叠,提示它们可能共同构成了一个神经-血管免疫微环境,协同调控早期修复反应。
核心结论:心脏修复是一个高度协调的过程,涉及成纤维细胞、血管细胞和施万细胞等多种基质细胞在时间(从激活到静息)和空间(从损伤中心到周边)上的精密协作,共同调控炎症、细胞外基质重塑和组织结构恢复。
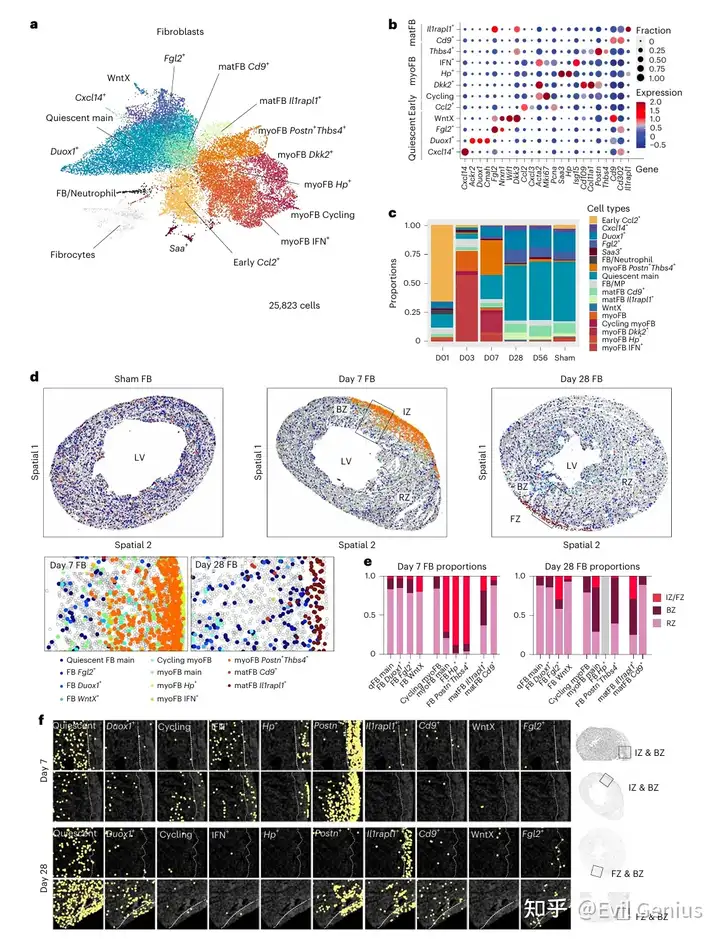
结果4、疤痕形成过程中微环境结构的显著重构
单个细胞类型的细胞状态会受到其局部微环境中异质性细胞相互作用的影响。使用NiCo分析了空间数据以识别这些微环境相互作用。NiCo训练一个逻辑回归分类器,根据一个细胞类型所有实例在其微环境内所有细胞类型的频率富集度来预测细胞类型身份。正的回归系数表示优先的相互作用,NiCo根据这些系数得出了假手术组、第7天和第28天的全局细胞类型相互作用图谱
与假手术组和第28天相比,在第7天观察到了更多独特的空间相互作用域:
- "纤维化微环境":由Postn⁺Thbs4⁺和Hp⁺肌成纤维细胞亚群主导,与Spp1ʰⁱᵍʰ和Trem2ʰⁱᵍʰ巨噬细胞(与既往观察一致)以及效应CD4⁺ T细胞、γδT细胞和调节性T细胞等T淋巴细胞共定位。
- "抗原呈递枢纽":上述淋巴细胞进一步与自然杀伤细胞、2型固有淋巴细胞、黏膜相关恒定T样细胞以及树突状细胞连接,在缺血区附近的淋巴结构周围形成聚集cluster。
- "边界区微环境":丰富的肥大心肌细胞与血管细胞和施万细胞共定位。
- "远端区微环境":其他心肌细胞亚群与毛细血管内皮细胞、初始T细胞、B细胞以及树突状细胞形成了相互作用枢纽。
- "心外膜微环境":心外膜细胞与心外膜来源的周细胞/成纤维细胞、肥大细胞、淋巴管和Spp1ʰⁱᵍʰ单核/巨噬细胞共聚集。
到第28天,这些相互作用枢纽大部分已基本解除。
淋巴细胞随时间推移在缺血区对单核/巨噬细胞命运的协调调控
在第7天,Ly6Cʰⁱᵍʰ/ᵐⁱᵈ、Spp1ʰⁱᵍʰ和Trem2ʰⁱᵍʰ巨噬细胞与多个淋巴细胞群共定位,包括2型固有淋巴细胞、黏膜相关恒定T样细胞和效应CD4⁺ T细胞。这些淋巴细胞是唯一表达Il4(一种已知可诱导抗炎巨噬细胞极化的细胞因子)的细胞。免疫荧光染色证实了第7天缺血区中IL-4⁺ 辅助性T细胞与Trem2ʰⁱᵍʰ巨噬细胞之间的这种高度邻近性。到第28天,这些淋巴细胞大部分被清除,而巨噬细胞获得了定居的Timd4⁺/Cx3cr1ʰⁱᵍʰ表型。
为验证这种通过IL-4信号传导的瞬时巨噬细胞-淋巴细胞相互作用是否驱动了推断的巨噬细胞状态顺序变化,模拟了随时间变化的缺血区/纤维化区巨噬细胞-淋巴细胞微环境条件。
- 模拟早期损伤环境:用心脏损伤相关分子模式、坏死细胞和干扰素-γ培养骨髓来源巨噬细胞24小时,模拟损伤后早期微环境。
- 模拟第3-7天相互作用:随后将骨髓来源巨噬细胞暴露于IL-4中48小时,模拟与IL-4⁺淋巴细胞的相互作用。
- 模拟第28天淋巴细胞清除:最后更换为无细胞因子培养基培养48小时。
在每个时间点收集骨髓来源巨噬细胞,通过流式细胞术分析其表面标志物。结果显示:
经损伤相关分子模式处理的骨髓来源巨噬细胞上调了Ly6Cʰⁱⁱᵍʰ/ᵐⁱᵈ/促炎表型的标志物。
随后暴露于IL-4与Ly6Cʰⁱᵍʰ/ᵐⁱᵈ标志物减少以及表达增殖标志物Mki67的Spp1ʰⁱᵍʰ、Trem2ʰⁱᵍʰ巨噬细胞比例增加相关。
IL-4撤除后,细胞Spp1ʰⁱᵍʰ/Trem2ʰⁱᵍʰ标志物减少,Mki67降低,但上调了定居巨噬细胞标志物。
为了确定这种IL-4驱动的效应是否确实由辅助性T细胞介导,修改了培养系统:不直接暴露于IL-4,而是让经损伤相关分子模式处理的骨髓来源巨噬细胞暴露于来自辅助性T细胞培养的上清液、与辅助性T细胞共培养、或与超活化辅助性T细胞共培养。在所有情况下,骨髓来源巨噬细胞的表型转变都类似于在IL-4培养中观察到的趋势。
总之,数据支持一个模型:瞬时的辅助性T细胞IL-4信号传导诱导促炎性单核/巨噬细胞向增殖性Trem2ʰⁱᵍʰ状态转变,随后进展为慢循环的定居表型。
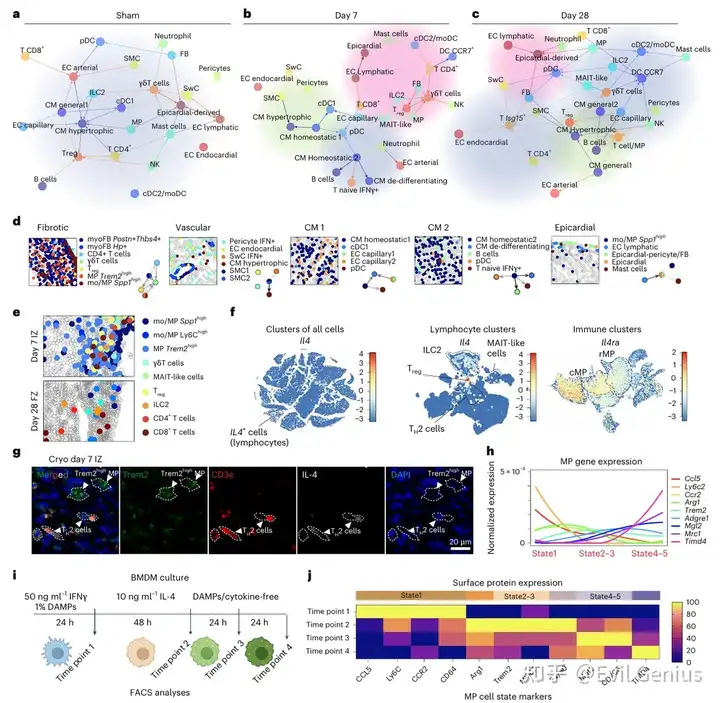
结果5、巨噬细胞与成纤维细胞相互调控增殖机制
病灶内巨噬细胞与成纤维细胞通过分子互作相互调控增殖
成纤维细胞和免疫细胞是心脏创伤愈合的关键决定因素。这两种细胞类型在损伤后早期(第1-7天)通过TNF、PDGF、IL-1β和IFNγ信号通路进行密集通讯,导致能量消耗增加、缺氧反应以及几种相互依赖的成纤维细胞状态的诱导,这一点已在时空数据、拟时序分析和体外培养中得到证实。
在第7天,Spp1ʰⁱᵍʰ 单核/巨噬细胞、Trem2ʰⁱᵍʰ 巨噬细胞和 Postn⁺Thbs4⁺ 肌成纤维细胞在缺血区密集富集。这些(肌)成纤维细胞与 Cx3cr1ʰⁱᵍʰ 巨噬细胞保持共定位直至第28天,但获得了 Il1rapl1⁺ 基质纤维细胞状态。
为了更深入了解细胞通讯对局部微环境内细胞状态的影响,应用了NiCo共变分析。该分析量化了共定位细胞类型中特定细胞类型的潜在基因程序(称为因子)的协同变化。在 Trem2ʰⁱᵍʰ 巨噬细胞 – Postn⁺Thbs4⁺ 肌成纤维细胞微环境中,NiCo共变分析显示成纤维细胞和巨噬细胞的潜在因子(分别为Fa3和Fa2)显著共变。
- 巨噬细胞因子(Fa3):与分泌性配体Gas6、补体因子、成熟巨噬细胞标志物Mrc1和生长因子Igf1正相关;与应激反应(Fos)、IFN通路(Ifitm3, Isg15)和促炎标志物Ly6c2负相关。
- 成纤维细胞因子(Fa2):与ECM重塑基因(Mmp2, Lum, Dcn)正相关;与细胞周期相关基因集负相关,并与端粒酶RNA定位于卡哈尔体的基因负相关,表明细胞周期和端粒酶活性降低。
所有空间切片中都一致地检测到相同的成纤维细胞-巨噬细胞共变模式.
接下来,试图识别控制肌成纤维细胞周期减少的配体-受体相互作用。与空间数据一致(揭示GAS6为潜在配体),通过CellChat进行的scRNA-seq配体-受体分析预测了Trem2ʰⁱᵍʰ, Cx3cr1ʰⁱᵍʰ/Timd4⁺ 巨噬细胞与肌成纤维细胞/基质纤维细胞之间存在 Gas6–Axl 和 Pros1–Axl 相互作用,主要发生在第7天和28天。这些数据共同表明,Trem2ʰⁱᵍʰ/Cx3cr1ʰⁱᵍʰ 巨噬细胞与成纤维细胞之间的相互作用导致了巨噬细胞炎症和增殖的沉默,以及成纤维细胞增殖的抑制。
通过多重免疫荧光在蛋白水平上验证了配体-受体的共定位。与空间数据一致,大量的肌成纤维细胞(CD140a⁺)和巨噬细胞(CD45⁺GAS6⁺PROS1⁺)紧密聚集在缺血区,但在边界区和远端区则没有。对从6周龄小鼠分离的成纤维细胞经TGFβ激活的肌成纤维细胞(αSMA⁺)进行免疫荧光分析,显示其表达GAS6/PROS1的受体AXL蛋白。
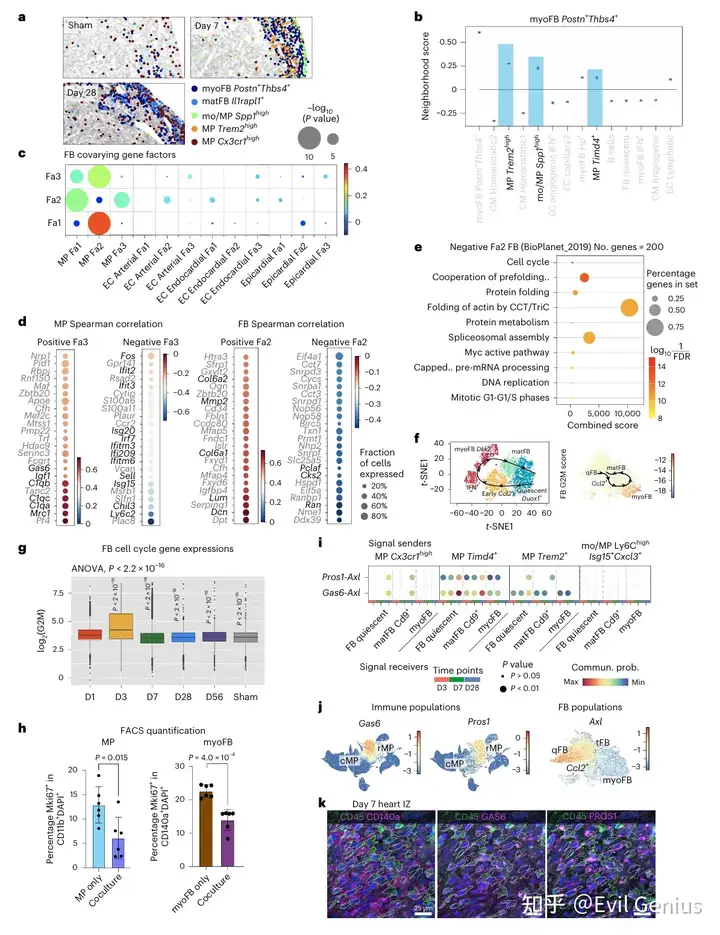
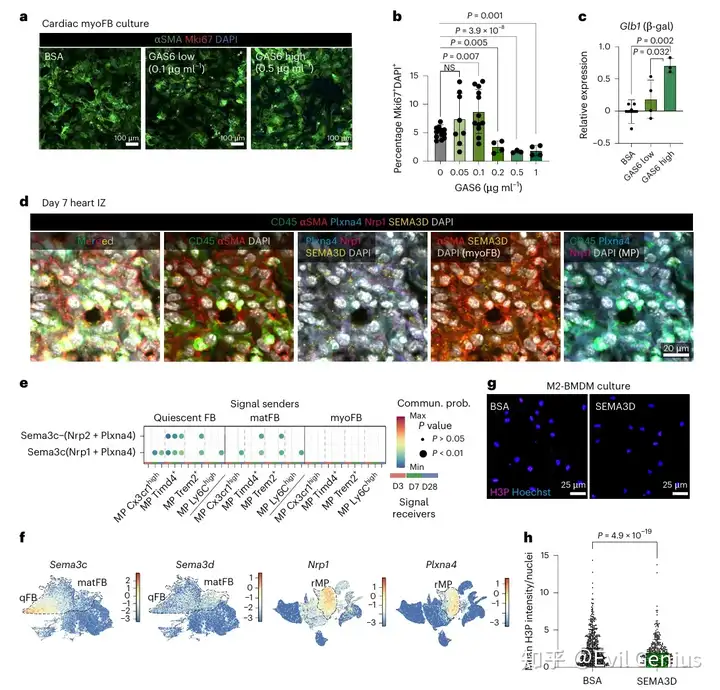
为了功能上验证此相互作用,在体外用重组小鼠GAS6配体培养肌成纤维细胞,并通过Mki67⁺ 细胞核染色评估增殖。肌成纤维细胞暴露于低浓度GAS6导致增殖轻微增加,而当GAS6超过 0.1 µg ml⁻¹ 时观察到相反效果,表明GAS6以浓度依赖性方式调控肌成纤维细胞增殖。对于高浓度的PROS1也观察到类似效应。由于空间NiCo分析表明第7天巨噬细胞-肌成纤维细胞相互作用导致端粒酶活性基因和细胞周期基因减少,评估了体外肌成纤维细胞培养物中衰老和细胞周期停滞标志物(如Glb1(β-半乳糖苷酶)、Trp53(p53)和Cdkn1a(p21))的表达。一致地,暴露于高浓度GAS6诱导了大多数这些基因的表达。因此,丰富的GAS6可以触发肌成纤维细胞的细胞周期停滞和细胞衰老。
接下来旨在确定介导抑制邻近Trem2ʰⁱᵍʰ 巨噬细胞增殖的、由肌成纤维细胞表达的配体。Semaphorin家族配体基因 Sema3d 的表达与成纤维细胞因子Fa2(在静息成纤维细胞和基质纤维细胞中富集)相关,而其受体基因 Nrp1 和 Plxna4 在定居巨噬细胞中上调;CellChat也预测了这种相互作用。通过对第7天心脏进行免疫荧光分析,证实了在缺血区存在分别表达SEMA3D和Nrp1/Plxna4的肌成纤维细胞和巨噬细胞的局部聚集,支持了空间细胞-细胞相互作用数据。在体外用重组小鼠SEMA3D配体培养BMDM,验证了其抑制增殖的功能,表现为平均核磷酸化组蛋白H3强度降低。
最后,探究这种肌成纤维细胞-巨噬细胞相互抑制机制是否在人类心脏中保守存在。重新分析了一个近期的人类心肌梗死snRNA-seq数据集,并聚焦于缺血区细胞,其中包含大量具有高细胞周期基因表达的肌成纤维细胞(PDGFRA⁺ACTA2⁺COL1A1ʰⁱᵍʰ)。髓系群体主要包括PTPRC⁺ITGAM⁺ 巨噬细胞,包含浸润的CCL18⁺ 和定居的LYVE1⁺ 表型。与小鼠中的观察相似,GAS6 表达在定居型 versus 循环型巨噬细胞中富集,而 AXL 在所有成纤维细胞中均有表达。用不同浓度的重组人GAS6配体处理原代人心脏TGFβ激活的肌成纤维细胞,通过免疫荧光Mki67⁺ 细胞核定量和Mki67表达qRT-PCR检测,导致了与小鼠心脏肌成纤维细胞相似的增殖变化趋势。综上所述,研究结果表明GAS6对心脏成纤维细胞增殖的调控是保守的。
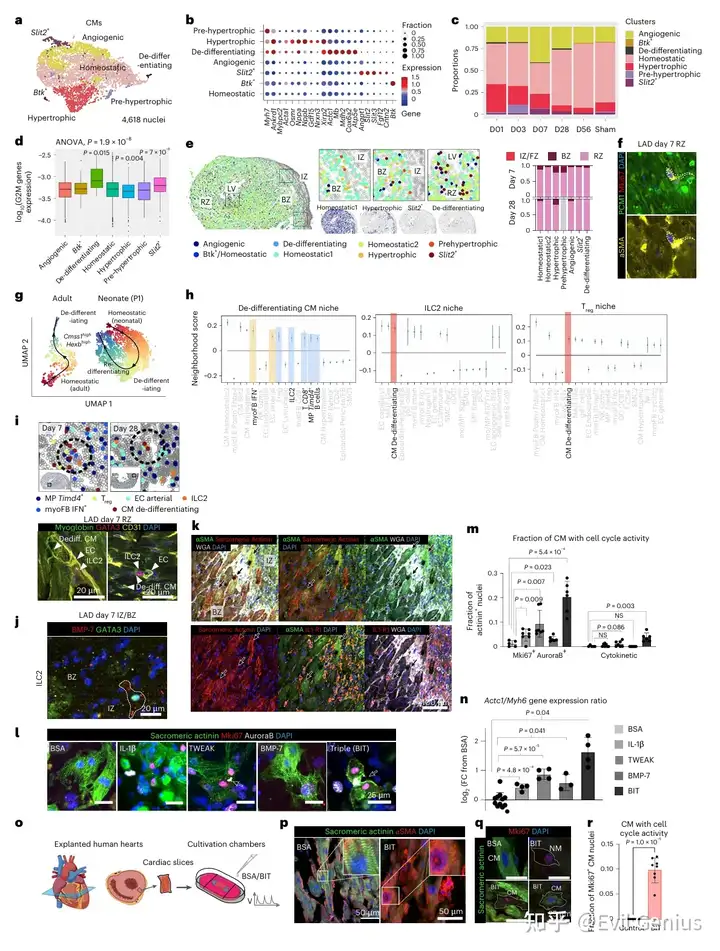
结果6、心肌细胞去分化由其微环境协同诱导
研究了心肌细胞去分化的潜在微环境驱动因素。所有的第7天空间样本都显示,去分化心肌细胞与2型固有淋巴细胞、调节性T细胞、CD8⁺ T细胞、B细胞、Timd4⁺ 定居巨噬细胞、干扰素⁺ 肌成纤维细胞和动脉内皮细胞邻近。免疫荧光证实了在边界区和远端区存在包含去分化心肌细胞、内皮细胞和2型固有淋巴细胞的微环境。这些邻近的细胞类型可能提供了驱动心肌细胞去分化的配体:
- 动脉内皮细胞 表达 TNFSF12
- 2型固有淋巴细胞 特异性表达 BMP-7
- 中性粒细胞 和 单核/巨噬细胞 表达 IL-1β
关键机制:任何一种信号单独作用效果有限,但三者联合能产生强大的协同效应,显著促进心肌细胞的去分化和增殖。
在人类衰竭心脏的组织和离体培养实验中,证实了同样的去分化现象和BMP-7等信号通路的功能保守性。
这表明,通过操控这一特定的微环境信号网络,有可能在成年人类心脏中激活潜在的可塑性程序,为心脏再生治疗提供了新的思路和靶点。
整个过程的作用机制
最后来看看方法


生活很好,有你更好
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
评论
登录后参与评论
推荐阅读
目录

