生化小课 | β构象将多肽链组织成折叠
生科/生技:生化书是我见过最厚的教材
没有之一
每周一堂
生化小课
—— 期末/考研 逢考必过——
β构象将多肽链组织成折叠
1951年,Pauling和Corey预测了第二种重复结构,即β构象(β conformation)。这是多肽链的一种更延伸的构象,其结构再次由根据一组特征二面角排列的主链原子定义。在β构象中,多肽链的主链延伸成锯齿状而非螺旋状结构(图4-5)。β构象中的单个蛋白质片段通常被称为β链。多条链并排排列,全部呈 β 构象,称为 β 折叠(β sheet)。单个多肽片段的之字形结构导致整个片的褶皱外观。氢键在片内多肽链的相邻片段的主链原子之间形成。形成β片的单个片段通常在多肽链上相邻,但在多肽的线性序列中也可能彼此相距很远;它们甚至可以在不同的多肽链中。相邻氨基酸的R基团从之字形结构中向相反方向突出,形成了图4-5侧视图中所示的交替模式。
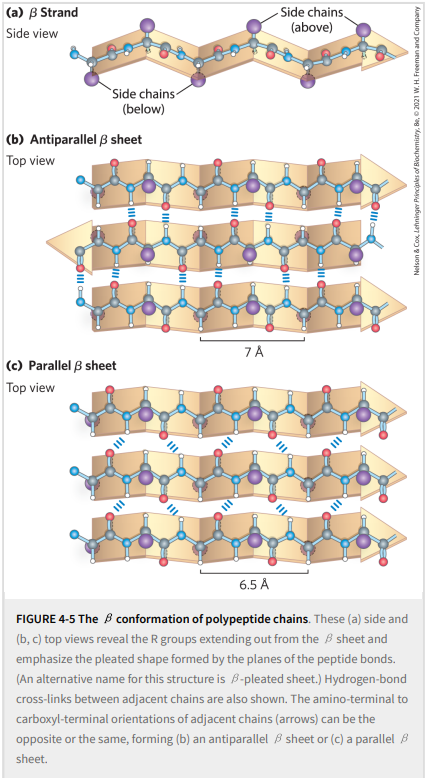
β折叠中的相邻多肽链可以是平行的或反平行的(分别具有相同或相反的氨基到羧基方向)。尽管平行构象的重复周期较短(反平行构象为6.5 vs. 7.0 Å)且氢键模式不同,但结构有些相似。在反平行β折叠中,链间氢键基本上是直线的,而在平行β片中,它们是扭曲的或不是直线的。在天然蛋白质中,反平行β 折叠的出现频率是平行β折叠的两倍。理想化结构的键角如表4-1所示;这些值在实际蛋白质中略有不同,导致结构变化,如上文所述的α螺旋。
Principles of Biochemistry
本栏目信息及图片均来源于Lehninger Principles of Biochemistry 第八版,其中文字信息为英文原版的小编翻译/整理版,仅供学习交流使用,欢迎在留言区或私信听课君提供宝贵意见,如有侵权请联系删除。
部分WORKED EXAMPLE及全部Chapter Review未纳入翻译整理范围,如有需要建议参考原版图书该部分内容学习。

