生化小课 | 反应速率和平衡具有精确的热力学定义
反应速率和平衡具有精确的热力学定义
反应平衡与反应的标准自由能变化 ΔG′° 密不可分,而反应速率与活化能 ΔG‡ 相关。了解这些热力学关系的基本介绍是了解酶如何工作的下一步。
诸如S⇌P的平衡用平衡常数(equilibriumconstant)Keq或简单的K来描述。在用于比较生化过程的标准条件下,平衡常数表示为K′eq(或K′):
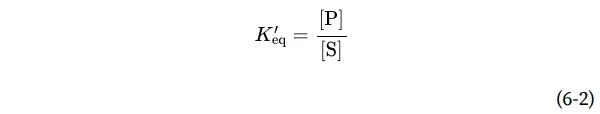
从热力学角度来看,K′eq和ΔG′°之间的关系可以用以下表达式来描述
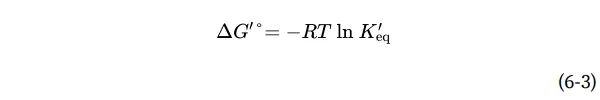
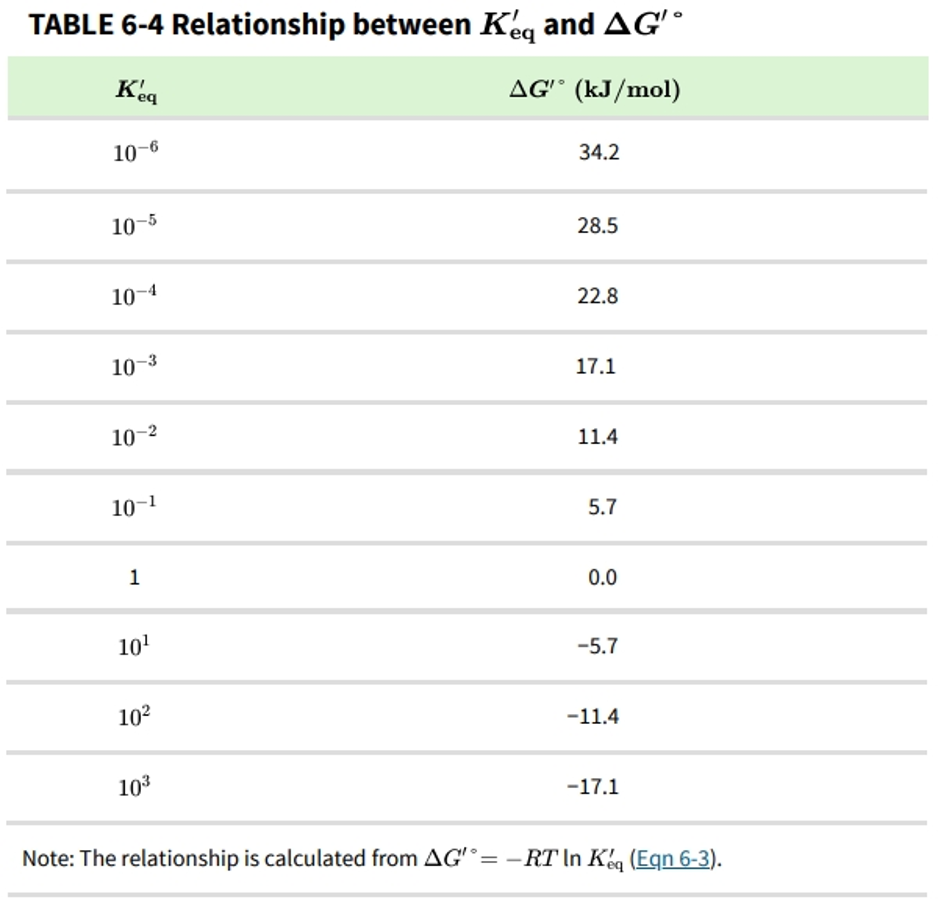
其中R是气体常数8.315 J/mol·K,T是绝对温度298 K(25℃)。第13章对方程6-3进行了详细的推导和讨论。这里的重要一点是,平衡常数与反应的总标准自由能变化直接相关(表6-4)。ΔG′°的负值较大,反映了有利的反应平衡(平衡时产物比底物多得多)——但如前所述,这并不意味着反应会快速进行。
任何反应的速率都由反应物的浓度和速率常数(rate constant)决定,通常用k表示。对于单分子反应S→P,反应的速率(或速度)V——表示每单位时间反应的S量——用速率方程(rate equation)表示:
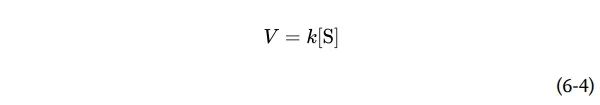
在这个反应中,速率只取决于S的浓度。这被称为一级反应。因子k是一个比例常数,反映了在给定条件(pH、温度等)下反应的概率。这里,k是一阶速率常数,具有倒数时间单位,例如s−1。如果一阶反应的速率常数k为0.03 s−1,则可以(定性地)解释为3%的可用s将在1秒内转化为P。速率常数为2000 s−1的反应将在一秒钟内结束。如果反应速率取决于两种不同化合物的浓度,或者如果反应是在同一化合物的两个分子之间进行的,则反应是二阶的,k是二阶速率常数,单位为M−1s−1。速率方程变为
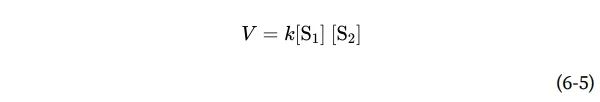
根据过渡态理论,我们可以推导出一个表达式,将速率常数的大小与活化能联系起来:
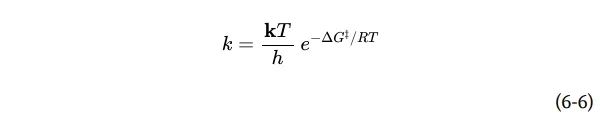
其中k是玻尔兹曼常数,h是普朗克常数。重要的一点是,速率常数k和活化能ΔG‡之间的关系是反比和指数关系。简单地说,这就是 "活化能越低,反应速度越快 "这一说法的基础,而酶的作用就是降低活化能。
现在我们从酶的作用转向它们是如何作用的。
Principles of Biochemistry
本栏目信息及图片均来源于Lehninger Principles of Biochemistry 第八版,其中文字信息为英文原版的小编翻译/整理版,仅供学习交流使用,欢迎在留言区或私信听课君提供宝贵意见,如有侵权请联系删除。
部分WORKED EXAMPLE、BOX及全部Chapter Review未纳入翻译整理范围,如有需要建议参考原版图书该部分内容学习。

