浙大团队打造MetalloDock:通过物理感知的 AI 方法进行 高精度金属蛋白-配体分子对接
浙大团队打造MetalloDock:通过物理感知的 AI 方法进行 高精度金属蛋白-配体分子对接

DrugIntel
发布于 2026-01-27 14:40:53
发布于 2026-01-27 14:40:53

金属蛋白(Metalloproteins, MPs)作为生命活动的关键调控者,其通过金属离子配位介导的酶催化、信号传导等功能,与肿瘤、神经退行性疾病、病毒感染等重大疾病的发病机制密切相关,已成为药物研发领域极具潜力的靶点家族。然而,金属-配体相互作用的几何多样性、电子复杂性以及现有计算方法的固有局限性,长期制约着金属蛋白靶向药物的高效开发。
近日,《JACS》刊发了浙江大学团队研发的MetalloDock框架,作为首个专为金属蛋白设计的深度学习分子对接工具,其创新性地融合物理约束与几何生成范式,为破解金属蛋白-配体相互作用预测难题提供了系统性解决方案,标志着金属蛋白药物研发进入精准计算的新阶段。
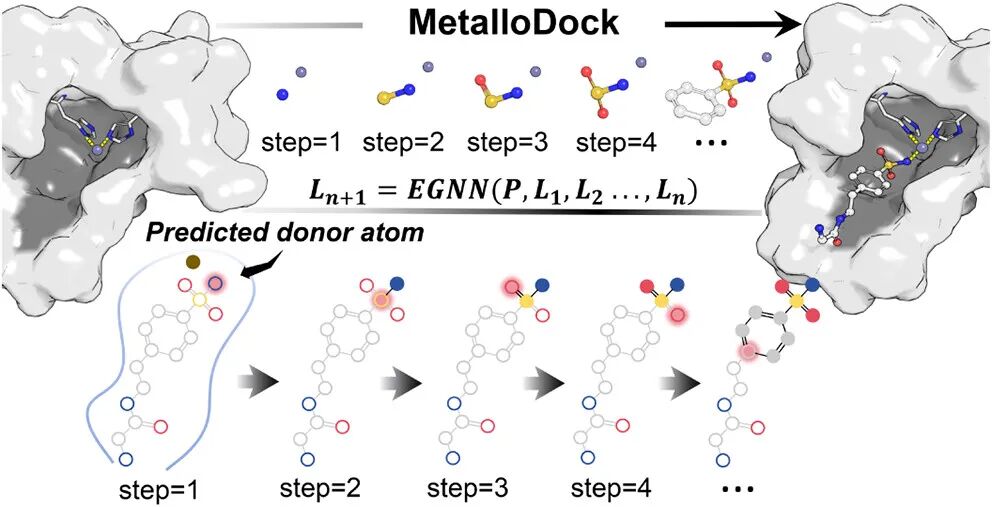
金属蛋白药物研发的核心技术瓶颈
金属蛋白的独特结构与作用机制,使 传统计算方法难以实现精准建模:
- 配位作用的复杂性:金属离子可采用多变的配位几何,其相互作用常涉及强烈的极化和电荷转移等效应的复杂特性。
- 现有工具的局限性:传统分子对接工具多局限于锌离子系统,缺乏对多类型金属的普适性;主流深度学习模型往往简化或忽略金属配位的特异性,并未针对金属蛋白-配体对接进行专门优化。
- 高质量数据的稀缺性:现有数据库中金属蛋白-配体复合物样本量有限,且大规模、高质量的金属蛋白-配体复合物数据集的稀缺。
MetalloDock的核心设计与技术创新
MetalloDock将自回归空间解码引擎与受物理约束的几何生成范式相结合,构建了多层次、模块化的计算框架,从表征、生成、优化三个维度实现金属蛋白-配体相互作用的精准预测:
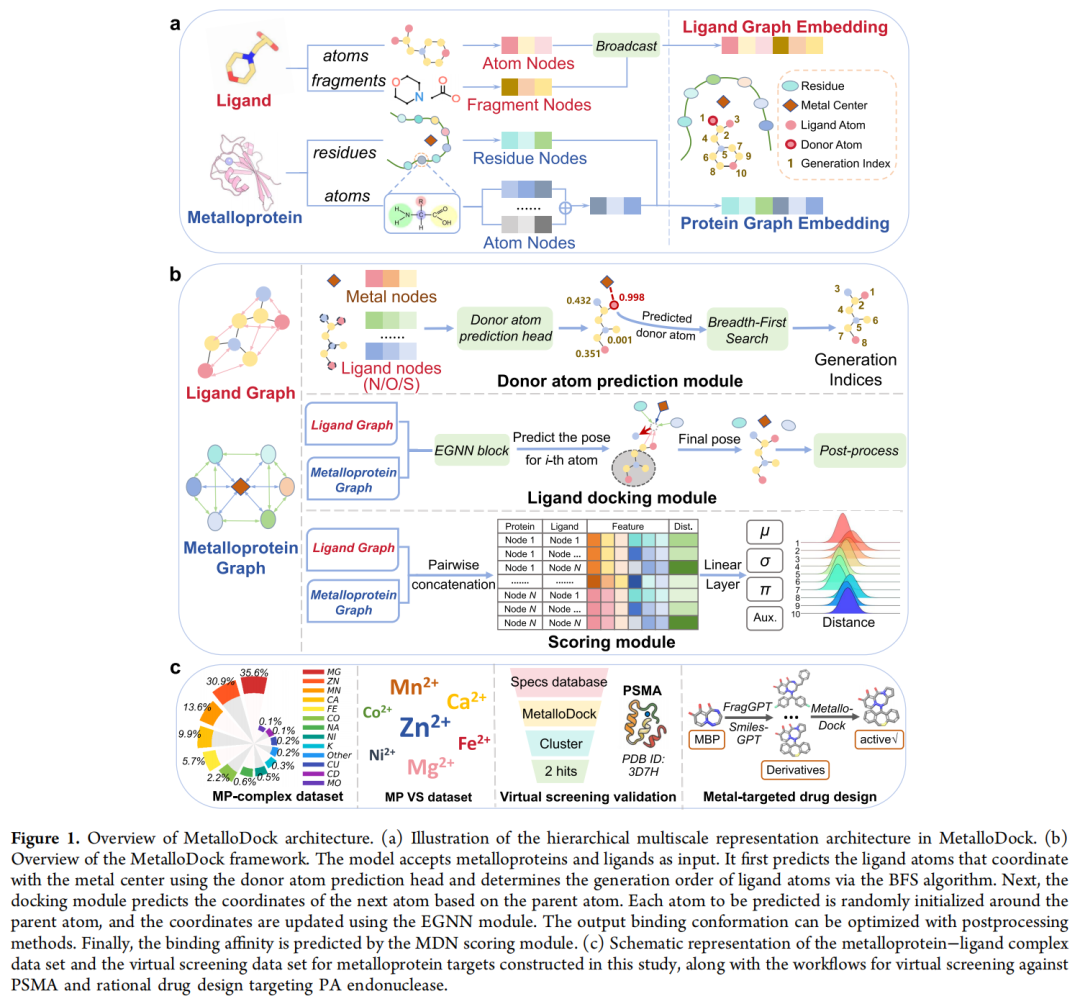
1. 分层多尺度表征架构
- 蛋白质表征:采用图Transformer(GT)提取原子级特征,通过聚合至残基水平,再与几何向量感知器(GVP)生成的残基特征融合,实现精细结构信息的向上传递。
- 配体表征:基于单键拆分配体为片段,利用图Transformer编码片段级化学语义特征,通过索引映射广播至原子节点,实现功能语义的向下渗透。
- 跨粒度融合:通过蛋白质的原子-残基混合表征与配体的原子-片段表征交叉融合,高效捕捉结合口袋内多尺度相互作用,同时降低计算开销。
2. 金属配位感知与几何生成机制
- 供体原子预测模块:基于蛋白质与配体的编码特征,概率性识别参与金属配位的供体原子(N/O/S),预测准确率达88.9%,为后续构象生成提供精准起点。
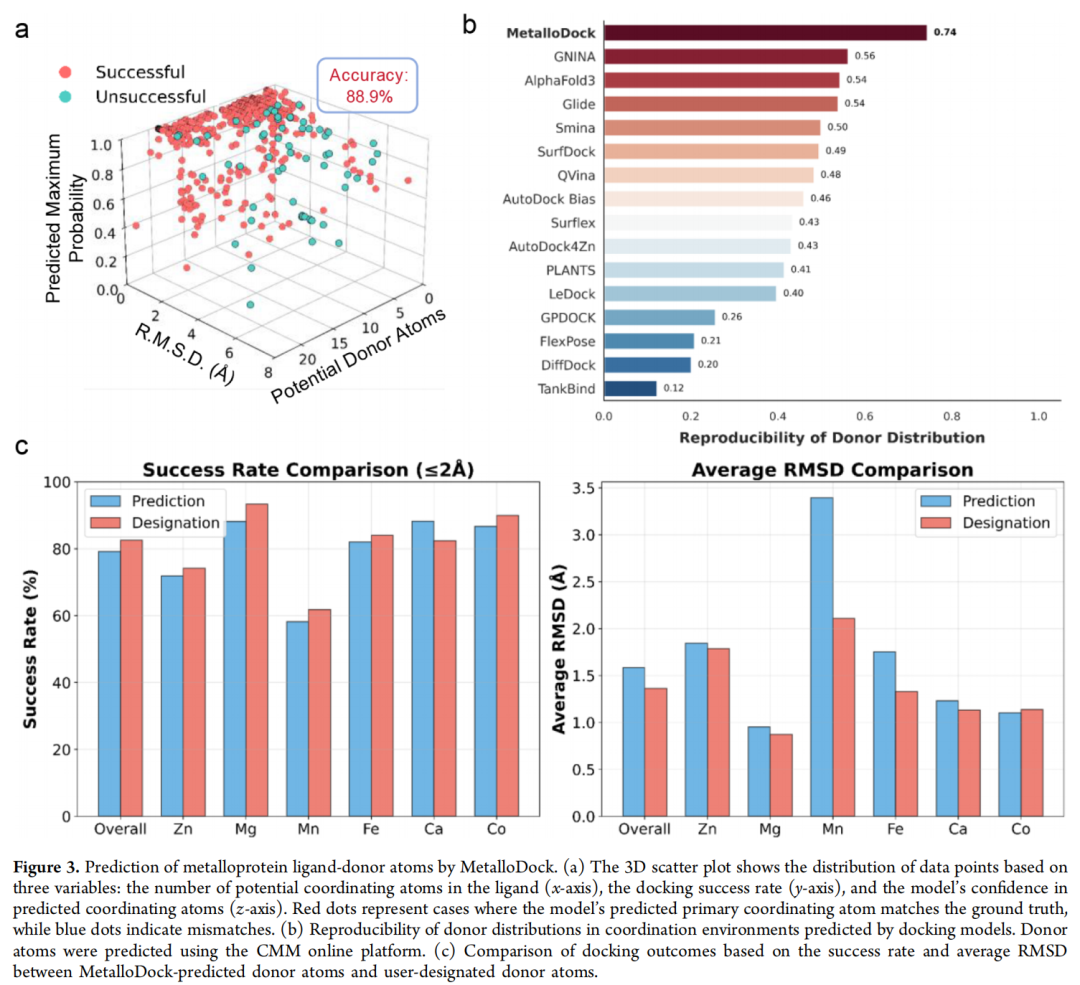
- 金属引导拓扑生长算法(MTGA):以金属中心为锚点,利用E(3)等变图神经网络(EGNN)优先预测供体原子坐标,明确纳入金属配位的物理先验;结合共价图驱动的广度优先搜索(BFS)算法确定原子生成顺序,确保化学合理性。
- 渐进式掩蔽策略:动态遮蔽未生成的下游原子,避免训练过程中的信息泄露,保障构象生成的序列保真度。
3. 混合密度网络(MDN)打分模块
通过建模氨基酸残基与配体原子间的距离概率分布,将其转化为统计势能,实现结合亲和力的精准量化。经CASF2016基准验证,微调后的模型在打分与排序任务中表现优异,为活性分子优先级排序提供可靠支撑。
4. 标准化基准数据集构建
- 金属蛋白-配体复合物数据集:从PDB数据库筛选8836个高质量样本,涵盖7种重要金属离子,严格控制配体相似性(≤0.8),按时间分层划分为训练集(7453个)、验证集(842个)和测试集(541个)。
- 虚拟筛选数据集:扩展DUD-E、DEKOIS2等传统数据集的金属蛋白子集,新增自主构建的靶点,形成包含23个高分辨率靶点的综合数据集,为模型筛选性能评估提供标准化平台。
性能验证:全面超越传统方法与主流DL模型
在多维度基准测试中,MetalloDock展现出卓越的性能优势,核心指标均达到当前最优水平:
1. 对接精度与构象合理性
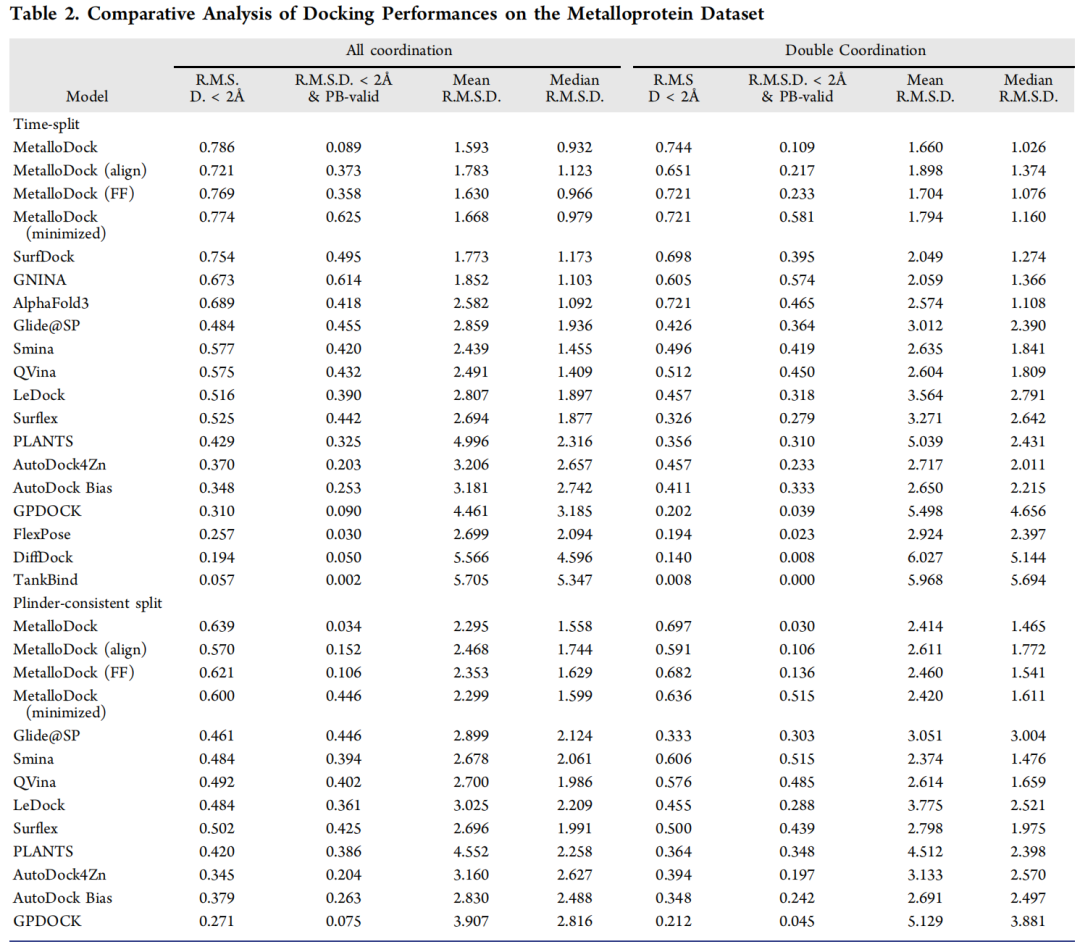
- 时间拆分测试集:对接成功率(RMSD<2Å)达78.6%,超越AlphaFold3(68.9%)、SurfDock(75.4%)及传统工具Glide@SP(48.4%);双金属配位系统中成功率仍达74.4%,有效捕捉协同配位作用。
- 构象合理性:经PoseBusters验证,通过能量最小化等后处理策略,构象物理可信度显著提升,与传统基于物理对接工具相当。
- 跨金属泛化能力:在Zn²⁺、Mg²⁺、Ca²⁺、Mn²⁺、Fe²⁺、Co²⁺等不同金属系统中均保持稳定性能,仅Mn²⁺系统略有下降,展现出强大的适配性。
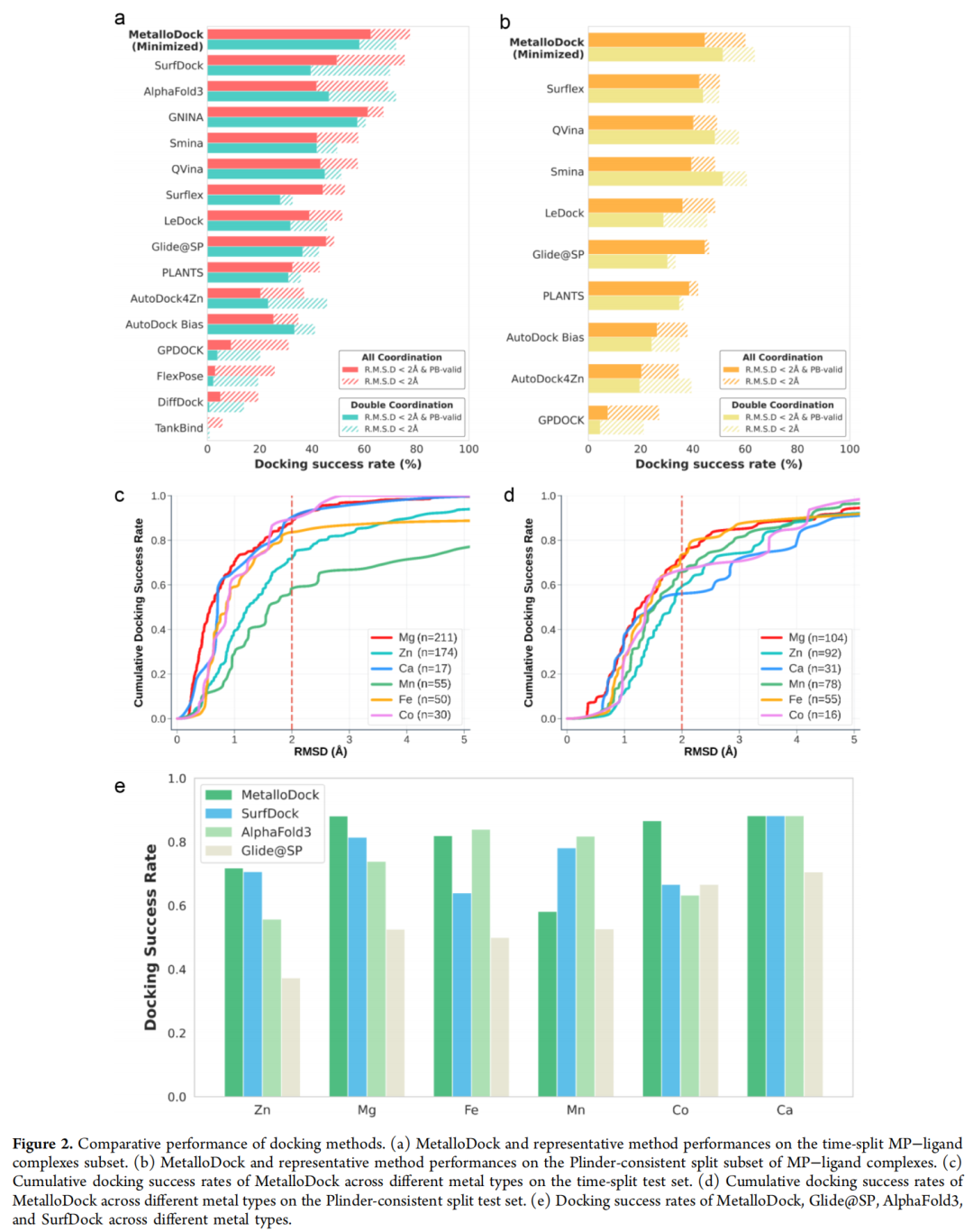
2. 金属配位几何重构精度
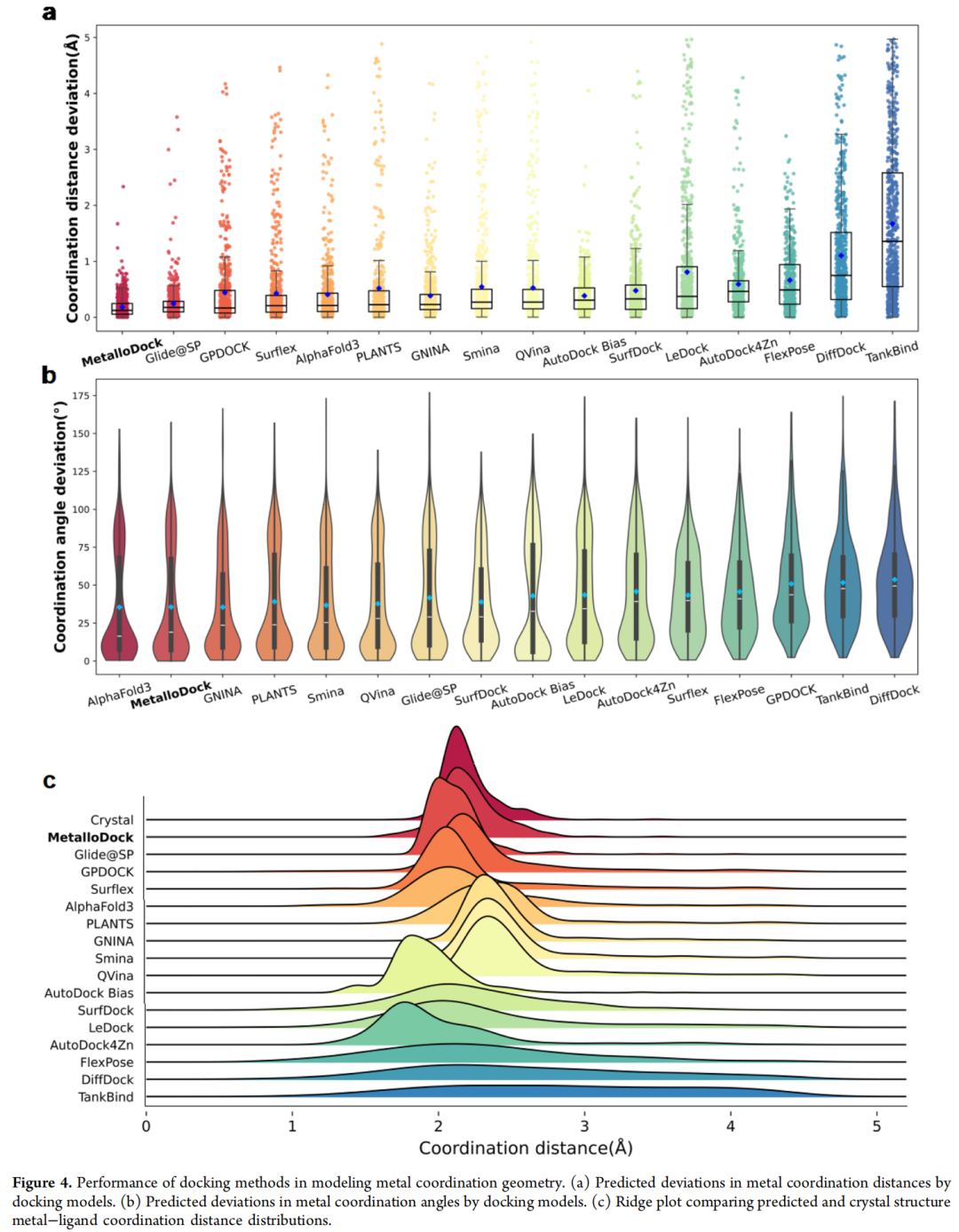
- 配位距离偏差:中位数偏差仅0.123Å,远低于其他对比方法,与晶体结构高度吻合。
- 配位角度偏差:中位数偏差18.98°,仅次于AlphaFold3,优于绝大多数传统工具与深度学习模型。
- 配位构型重现率:通过CMM在线平台验证,重现率达67%,为所有评估方法中最高,精准复现金属配位的几何特征。
3. 虚拟筛选效率
- 核心指标领先:在BED_ROC、ROC_AUC、PR_AUC及富集因子(EF)等指标上全面超越11种主流对接方法,其中MetalloDock(FF)在Top 0.5%化合物中的富集因子达21.8,大幅提升活性分子筛选效率。
- 领域级验证:在结构相关靶点的领域级分析中,仍保持最优性能,有效规避靶点冗余带来的评估偏差。
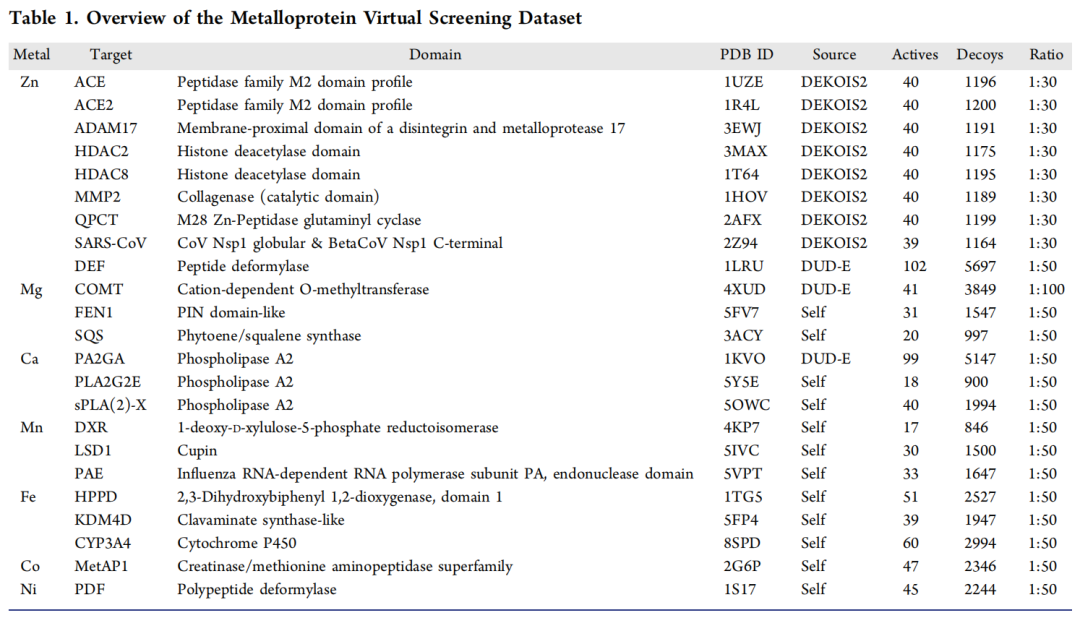
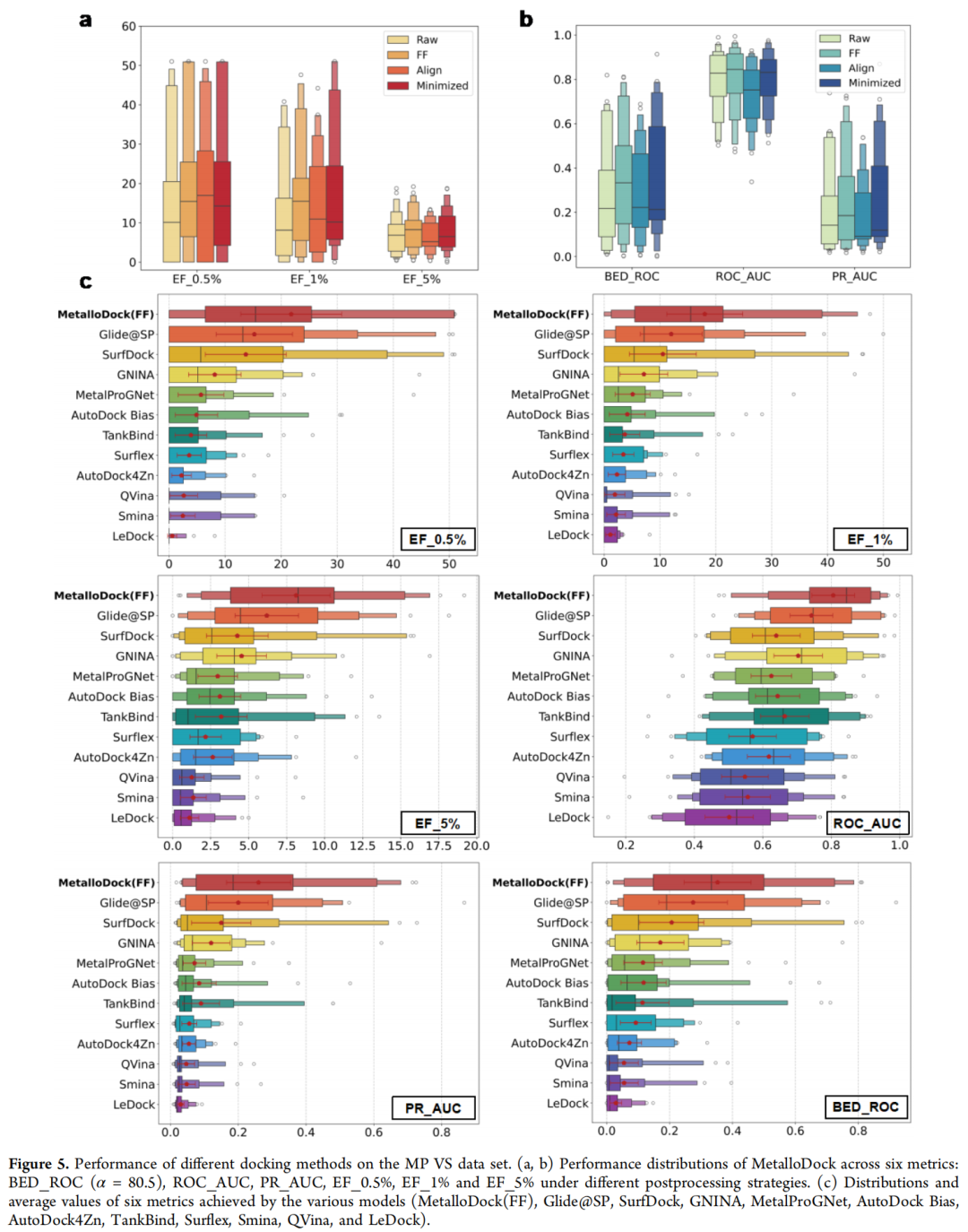
实战应用:从虚拟筛选到合理药物设计
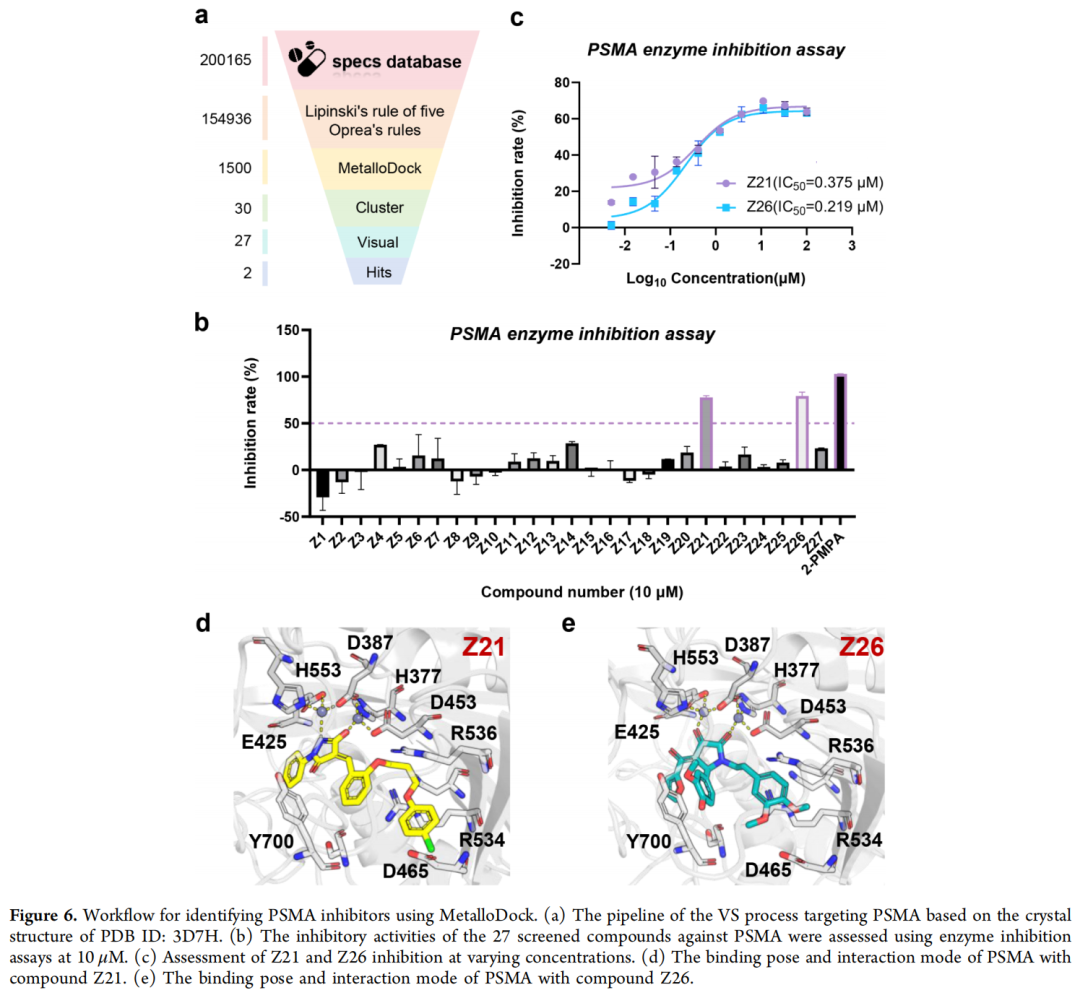
1. 前列腺特异性膜抗原(PSMA)抑制剂发现
- 筛选流程:基于PDB ID:3D7H结构,对Specs数据库(~20万化合物)进行虚拟筛选,经药物相似性过滤(违反≤2条Lipinski规则或≤3条Oprea规则),聚类得到30组代表性化合物,合成27个结构多样的代表性分子进行湿实验验证。
- 成果:发现2个高活性抑制剂(Z21、Z26),IC₅₀值分别为0.375μM和0.219μM,均含针对Zn²⁺的金属结合药效团(MBP),为前列腺癌治疗提供新型候选分子。
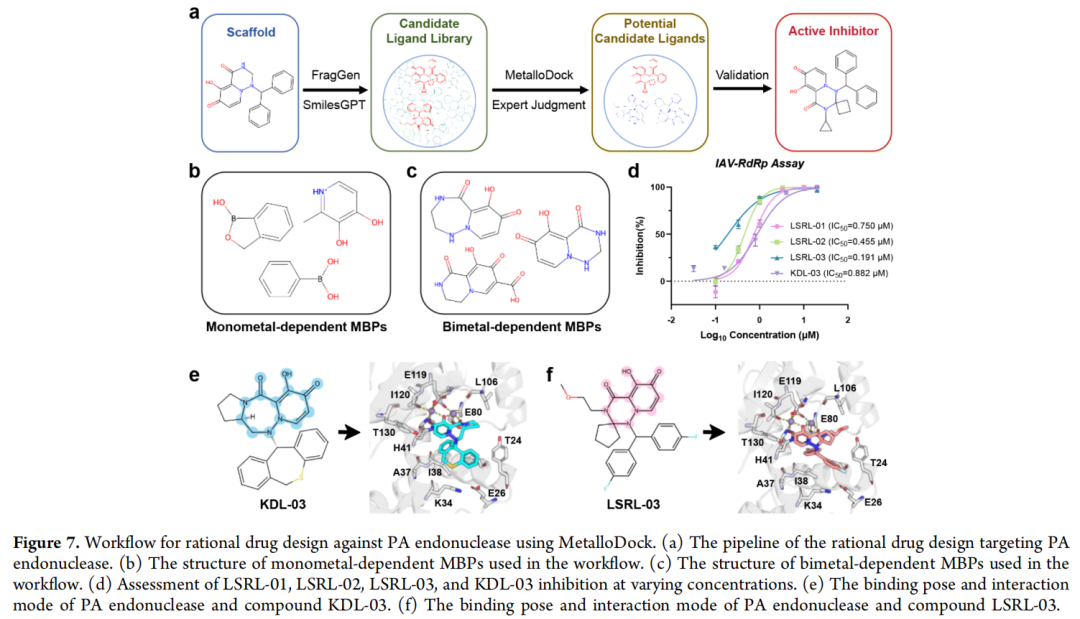
2. 流感病毒PA核酸内切酶抑制剂理性设计
- 设计策略:以单金属依赖型(3个)和双金属依赖型(3个)MBP为核心骨架,通过FragGen和SmilesGPT进行结构扩展,构建候选库;经MetalloDock对接评分,筛选合成22个化合物。
- 成果:5个单金属依赖型化合物表现出中等抑制活性,4个双金属依赖型化合物达到亚微摩尔级活性,最优化合物IC₅₀值为191nM,成功解决双金属酶抑制剂设计中稳定螯合的技术难题。
未来展望与应用价值
MetalloDock的模块化设计使其具备良好的扩展性,未来可与QM/MM精修协议整合,更精准捕捉极化、电荷转移等电子效应,进一步提升复杂配位环境下的结构保真度与能量排序精度。其开源特性为全球研究者提供了标准化工具,有望推动金属蛋白靶向药物研发的范式革新。
在应用层面,MetalloDock不仅适用于肿瘤、病毒感染等疾病的抑制剂发现,还可拓展至金属离子相关的酶工程、生物催化等领域,为精准医疗与绿色生物制造提供核心技术支撑。随着训练数据集的持续扩充与模型的迭代优化,MetalloDock将进一步缩小计算建模与实验验证的差距,加速金属蛋白药物从实验室走向临床的进程。
参考文献:Hui Zhang, Xujun Zhang, Qun Su, et al. MetalloDock: Decoding Metalloprotein–Ligand Interactions via Physics-Aware Deep Learning for Metalloprotein Drug Discovery, Journal of the American Chemical Society.
代码链接:https://github.com/SII-ZhangHui/MetalloDock
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2026-01-19,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读
目录

