Nat. Commun. | 自由能计算驱动的全激酶组选择性探索:以 Wee1 为例的药物研发新策略
Nat. Commun. | 自由能计算驱动的全激酶组选择性探索:以 Wee1 为例的药物研发新策略

DrugAI
发布于 2026-01-06 11:48:47
发布于 2026-01-06 11:48:47
DRUGONE
优化靶点和非靶点的效力是开发有效且选择性小分子药物的关键。自由能计算能够在数小时内提供接近实验精度的效力预测,从而高效识别有前景的化合物,加速早期药物研发。虽然此类预测通常应用于单一蛋白,但研究人员提出了一种适用于全激酶组选择性的自由能框架,并成功用于发现选择性 Wee1 激酶抑制剂。通过配体相对结合自由能计算,快速识别了多个新颖且高效的化学骨架。进一步利用蛋白残基突变自由能计算(以 Wee1 gatekeeper 残基为修饰点),显著降低了化合物在全激酶组中的非靶点风险。该策略展示了如何同时优化靶点和非靶点效力,为减少非预期毒性并加快药物研发提供了路线图。

在药物发现过程中,效力优化至关重要。若靶点效力不足,治疗无法达到预期效果;若选择性不足,则容易引发非靶点结合和体内安全风险。特别是对激酶抑制剂而言,由于 ATP 结合位点的高度保守,实现全激酶组选择性具有挑战。
自由能模拟是结构基础药物研发的重要工具,能够通过相对结合自由能方法预测设计分子的效力。然而,当涉及众多潜在非靶点时,传统的逐一建模方式计算负担过重。研究人员提出利用蛋白残基突变作为“选择性手柄”,通过点突变模拟来区分不同激酶家族的结合特性,从而在保持靶点效力的同时提升选择性。
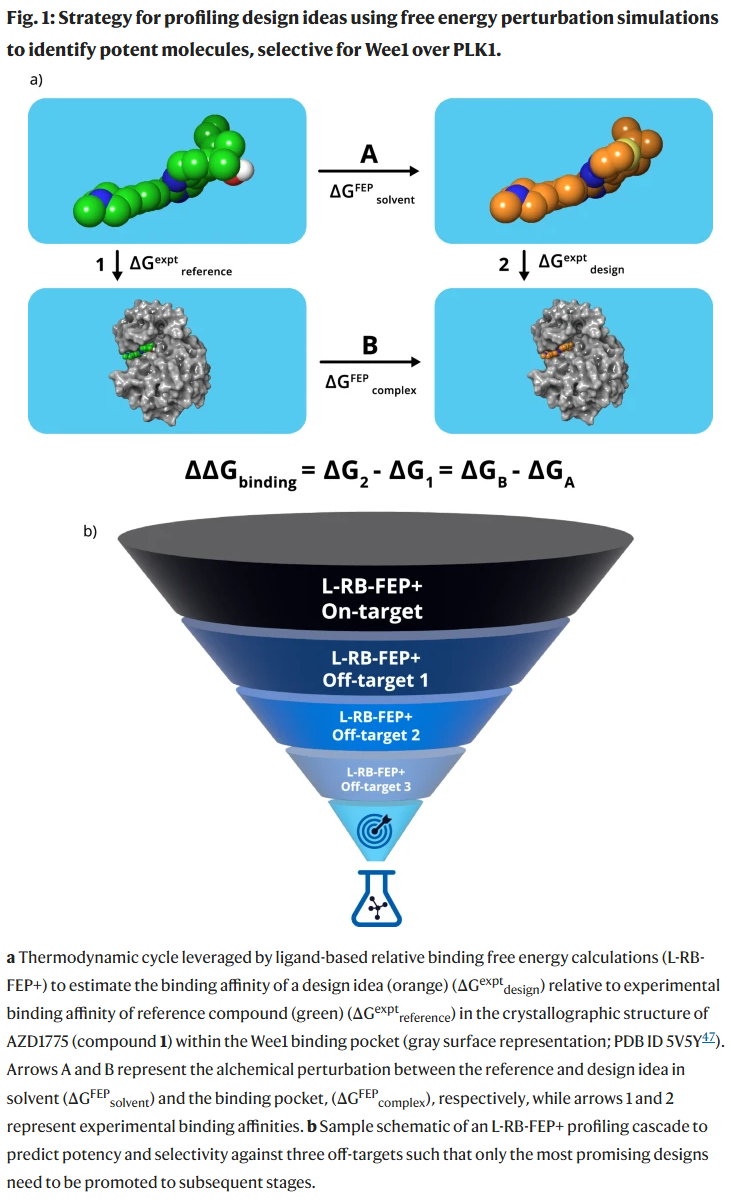
在此背景下,Wee1 作为 G2-M 细胞周期检查点的关键激酶,因其在癌细胞 DNA 修复依赖中的重要性而成为肿瘤药物研发的热点。尽管已有多个 Wee1 抑制剂进入临床,但尚无获批药物,且早期候选因非靶点毒性而失败。因此,探索高选择性 Wee1 抑制剂具有重要价值。
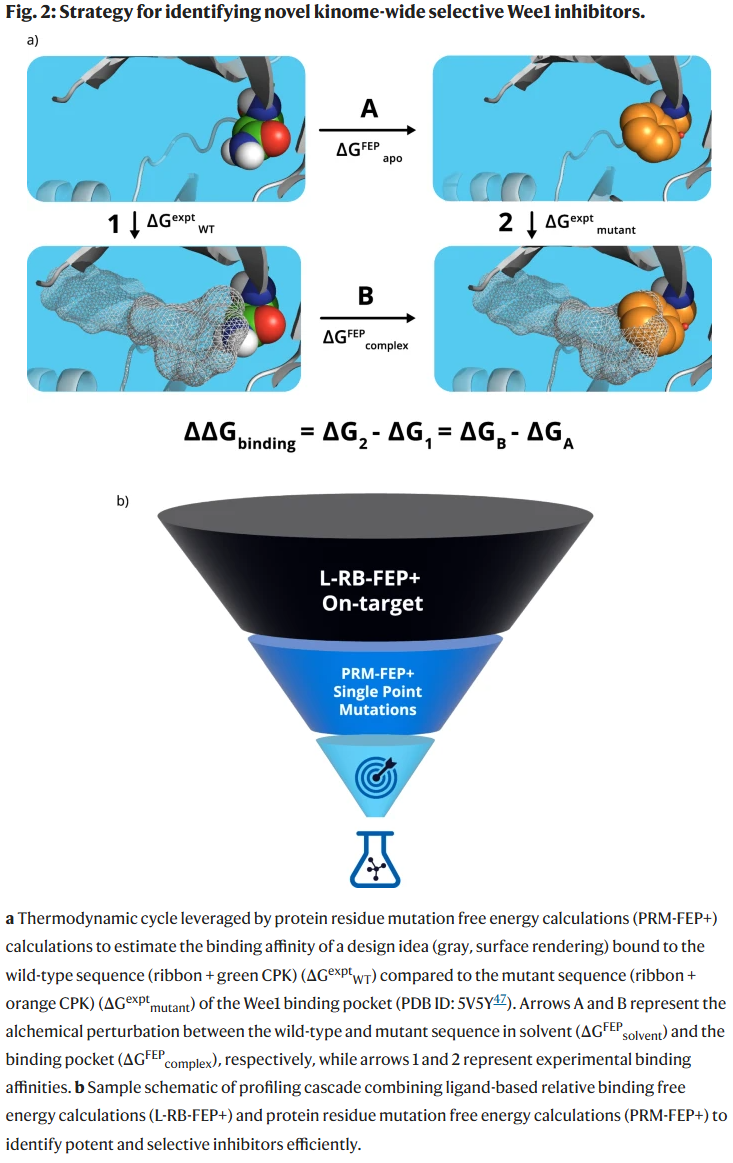
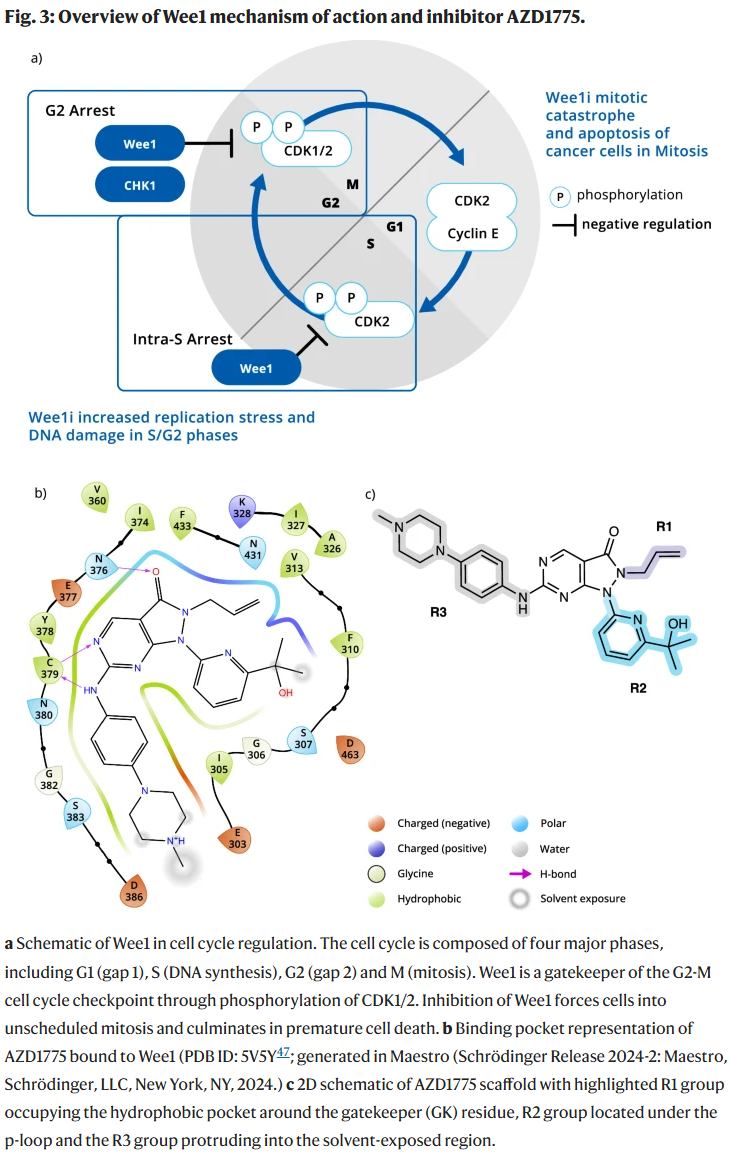
结果
快速识别新型高效化学系列
研究人员通过大规模分子设计与自由能筛选,短期内在 67 亿个设计分子中筛选出 9000 个候选,最终优先合成 80 个,其中多个系列表现出纳摩尔级 Wee1 活性,并对 PLK1 具有高达 1000 倍的选择性。
蛋白残基突变自由能计算揭示选择性规律
在全激酶组 403 个激酶的实验检测中,新系列分子仍存在多靶点问题。研究人员利用 Wee1 特有的 Asn gatekeeper 残基作为切入点,进行突变自由能计算。结果显示,该方法能够准确区分不同骨架的选择性特征,并以约 91% 的准确率预测化合物是否倾向于结合其他 gatekeeper 家族的激酶。这是首次将该策略成功应用于全激酶组选择性预测。
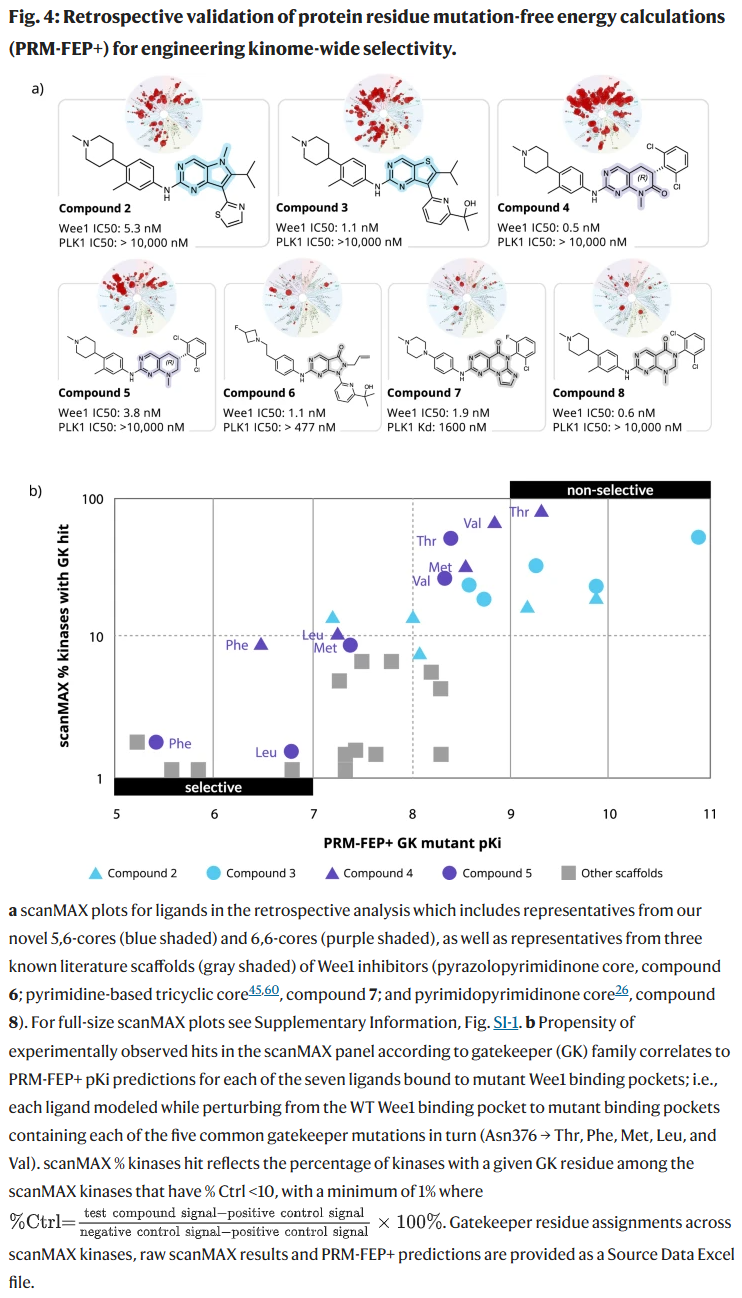
通过突变自由能计算实现系列选择性优化
在三个月内,研究人员对 6000 多个化合物进行计算分析,并优先合成 42 个。其中 22 个分子在保持纳摩尔级 Wee1 效力的同时,显著改善了选择性,表现优于已知临床候选 AZD1775。多个代表性骨架(5,6-核、6,6-核、三环结构)在实验中验证了这一预测策略的有效性。
发现新型高效骨架
研究人员进一步探索了新的三环骨架,结合自由能计算和实验验证,获得了 IC50 低至 1 nM 的候选物,并在全激酶组筛选中仅命中极少数激酶,展现出优异的选择性。
细胞水平与 ADME 特性
部分优化化合物在癌细胞系中验证了 Wee1 靶点作用(通过检测 CDK1 磷酸化)及抑制细胞增殖的效果,并表现出良好的体外药代性质。
讨论
该研究展示了一种结合配体相对结合自由能计算和蛋白残基突变自由能计算的高效策略:
- 高效识别候选物:在早期即通过计算筛选减少实验开销。
- 提升选择性:利用 gatekeeper 残基差异作为“选择性手柄”,快速预测并优化全激酶组选择性。
- 可扩展性:该策略不仅适用于激酶,还可推广至其他蛋白家族(如蛋白酶、GPCR、核受体),在存在序列和结构同源性的场景中尤其适用。
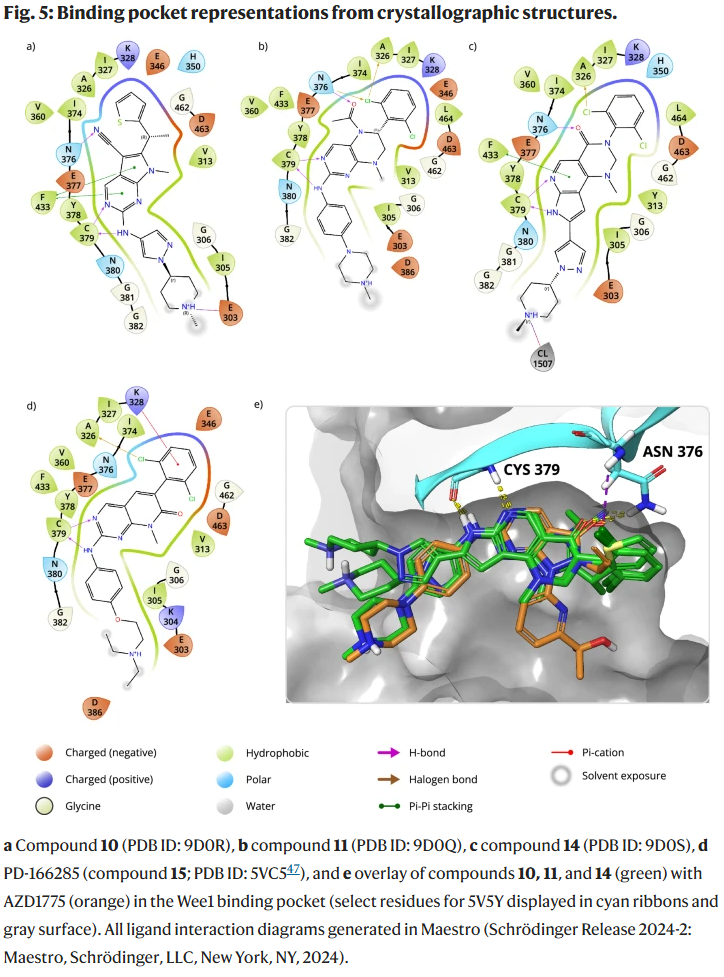
- 结构学验证:晶体结构表明,多种骨架能够通过不同方式与 Wee1 gatekeeper Asn376 形成氢键,解释了其高选择性。
总体而言,这一基于物理的计算方法显著提升了药物研发的效率,能够在早期阶段同时解决效力与选择性难题,为未来精准药物设计提供了强有力的工具。
整理 | DrugOne团队
参考资料
Knight, J.L., Clark, A.J., Wang, J. et al. Harnessing free energy calculations for kinome-wide selectivity in drug discovery campaigns with a Wee1 case study. Nat Commun 16, 7962 (2025).
https://doi.org/10.1038/s41467-025-62722-w
内容为【DrugOne】公众号原创|转载请注明来源
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2025-09-03,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读

