有了单细胞数据的类器官研究其实可以不做常规基因组和转录组啦
前面我们提到了早期的在每个癌症领域的类器官CNS文章已经是非常一致的展现了类器官培养的成功性,在常规的转录组和肿瘤外显子层面的异质性,药物反应情况,以至于后面的研究没办法做下去了。
恰好单细胞时代到了,可以让之前的CNS类器官研究文章继续“复制粘贴一波”,比如2021发表Advanced Science期刊的类器官文章:《Single-Cell Transcriptome Analysis Uncovers Intratumoral Heterogeneity and Underlying Mechanisms for Drug Resistance in Hepatobiliary Tumor Organoids》,就已经舍弃了传统的常规的转录组和肿瘤外显子数据,仅仅是看单细胞转录组。详见:只有单细胞转录组数据的肿瘤类器官研究(肝癌)。但是它主要是关心的是肿瘤病人内部的异质性,每个病人内部降维聚类分群后看特征基因,做拟时序分析看变化趋势,并没有展示类器官培养的成功性。
如果是外显子测序,那就是从肿瘤外显子的SNV和CNV两个分析结果的角度来说明类器官能非常好的维持其来源的原位肿瘤的基因组层面的突变信息,这样就说明了类器官可以成为肿瘤病人的精准医疗替身!实际上有了单细胞数据,也可以做同样的分析看拷贝数变异,比如2024的文章:《Single-cell transcriptome profiling of primary tumors and paired organoids of pancreatobiliary cancer》,数据集在:GSE214295 (PRJNA885258)
we conducted scRNA-seq for paired primary tumors and organoids from one cholangiocarcinoma (CCA) and two pancreatic ductal adenocarcinoma (PDAC) patients.
GSM6603324 Primary001, scRNAseq
GSM6603325 Primary002, scRNAseq
GSM6603326 Primary003, scRNAseq
GSM6603327 PDO001, scRNAseq
GSM6603328 PDO002, scRNAseq
GSM6603329 PDO003, scRNAseq
同样的,很容易读取这个GSE214295数据集的表达量矩阵文件,构建成为Seurat对象。仍然是走常规的单细胞转录组降维聚类分群代码,可以看 链接: https://pan.baidu.com/s/1bIBG9RciAzDhkTKKA7hEfQ?pwd=y4eh ,基本上大家只需要读入表达量矩阵文件到r里面就可以使用Seurat包做全部的流程,如下所示的第一层次降维聚类分群图:
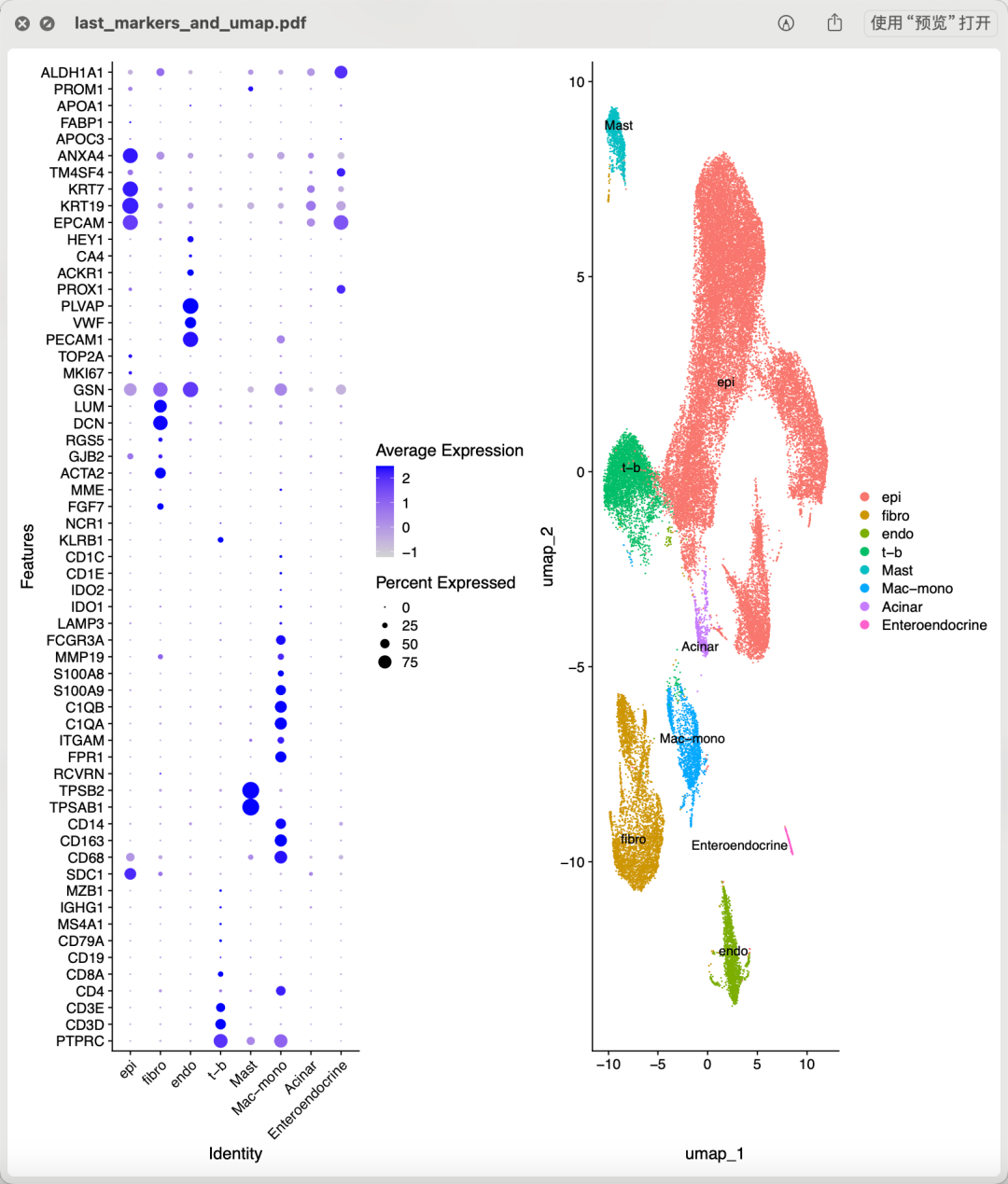
第一层次降维聚类分群
CNV层面
这个时候可以把里面的上皮细胞和Acinar细胞提取处理去做拷贝数分析,值得注意是在CCA里面的恶性上皮细胞和在PDAC的恶性上皮细胞来源是不一样的,前者是肝脏胆管上皮细胞,后者是胰腺导管上皮细胞。跑完inferCNV可以很清晰的看到,同一个病人培养前后确实是拷贝数变化情况仍然是维持了一致性,这样就说明了类器官可以成为肿瘤病人的精准医疗替身!

当然了,上面的图是“鸟瞰”全景图,还是得靠主观感觉来说同一个病人培养前后确实是拷贝数变化情况仍然是维持了拷贝数的一致性,但是理论上应该是有其它更好的统计方法,比如看相关性热图等等,大家可以集思广益,欢迎留言参与讨论!
而且从上面的图可以很清晰的看到2号病人的原位肿瘤里面有一堆细胞,是Acinar细胞,它没有拷贝数变异,是正常二倍体的上皮细胞,而且它并不会出现在2号病人的类器官培养物里面。这个是为什么呢?同样的上皮细胞为什么胰腺导管上皮细胞会恶化,而Acinar细胞绝不会呢?生命科学领域居然有绝对的事情了!!!
SNV层面
前面的数据集GSE214295 (PRJNA885258) 是有上传对应的测序数据的,理论上也可以走单细胞转录组层面的SNV流程,大家试试看。最新的一个工具是SComatic,发表在2023,文章标题是:《De novo detection of somatic mutations in high-throughput single-cell profiling data sets》,还是蛮强大的:
detection of somatic mutations in single-cell transcriptomic and ATAC-seq (assay for transposase-accessible chromatin sequence) data sets directly without requiring matched bulk or single-cell DNA sequencing data.
另外,既然都有了单细胞转录组表达量矩阵,理论上常规的bulk转录组矩阵也是可以通过AggregateExpression函数获得!
av <-AggregateExpression(sce ,
group.by = "RNA_snn_res.0.8" ,
assays = "RNA")
av=as.data.frame(av[[1]])
head(av) # 可以看到是整数矩阵
av=av[ rowSums(av>0) > 1 ,]
write.csv(av,file = 'av-RNA_snn_res.0.8.csv')
av <-AggregateExpression(sce ,
group.by = "celltype" ,
assays = "RNA")
av=as.data.frame(av[[1]])
head(av) # 可以看到是整数矩阵
av=av[ rowSums(av>0) > 1 ,]
write.csv(av,file = 'av-celltype.csv')
colnames(sce@meta.data)
av <-AggregateExpression(sce ,
group.by =c( "celltype" ,"orig.ident" ),
assays = "RNA")
av=as.data.frame(av[[1]])
head(av) # 可以看到是整数矩阵
av=av[ rowSums(av>0) > 1 ,]
write.csv(av,file = 'av-celltype-by-orig.ident.csv')
也就是说,有了单细胞数据的类器官研究其实可以不做常规基因组和转录组啦!
