Nat. Commun. | AlphaFold2进行高通量预测蛋白质构象分布
Nat. Commun. | AlphaFold2进行高通量预测蛋白质构象分布

今天为大家介绍的是来自Brenda M. Rubenstein团队的一篇论文。论文提出了一种创新方法,利用AlphaFold 2这一革命性的人工智能技术预测蛋白质构象的相对分布。AlphaFold 2通过精确预测蛋白质结构,已经在生物学领域引发了革命。尽管AlphaFold 2在准确性和速度方面表现出色,但它主要用于预测蛋白质的基态构象,预测构象景观的能力有限。作者在这里展示了AlphaFold 2如何通过对多序列对齐进行子样本抽样,直接预测不同蛋白质构象的相对分布。

一系列研究发现AlphaFold 2(AF2)默认算法在预测蛋白质的备选构象及序列变异效果方面存在局限性。尽管AF2无法预测多种构象这一点鉴于其初衷并不令人意外,但如果能够预测不同构象,这将和准确预测基态一样具有革命性意义。目前研究人员已经设计了新的方法,利用AF2方法来探测构象变化,在一些测试案例中取得了显著的成功。尽管AF2传统上无法预测构象集合,研究人员发现,通过对输入的多序列对齐(MSAs)进行子样本抽样并增加预测次数,可以导致捕获来自同一序列的不同生理相关构象的结构集合。这些预测可以作为分子动力学(MD)模拟的种子,用来探索更广泛的构象空间及每个预测状态的相对分布。

图 1
在这里,作者展示了如果目标是以高通量方式发现主要的备选构象及其相对分布,例如对比同源物或一个蛋白质兴趣序列的等位基因系列的动态差异,那么分子动力学(MD)模拟步骤可能是不必要的。由于AF2是通过解码共进化信号工作的,而且之前的工作已经表明,对多序列对齐(MSAs)进行子样本抽样可以准确预测同一蛋白质的不同构象,因此假设仅从序列数据中解码出构象抽样的某些指令似乎是合理的。如果这一假设成立,AF2和其他基于AI的方法就能够量化序列编码的动态信号,这将使预测不仅是同一蛋白质的备选构象,还有其相对状态分布中的变化成为可能。以此为动机,作者展示了如何通过对多序列对齐进行子样本抽样来生成蛋白质构象的集合(见图1)。
多序列对齐(MSA)子样本抽样进行了优化

图 2
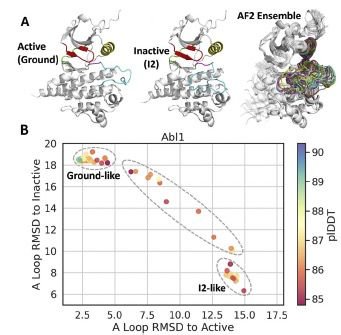
图 3
近年来,多个研究小组观察到,通过不同的参数和MSA深度,AF2能够仅基于序列数据预测构象变化。这些不同的AF2流程共享一个原则,即通过对MSAs进行子样本抽样,以调整不同结构域的共进化信号。在其标准实现中,AF2接受一个目标序列和相应的多序列对齐作为输入。从主MSA中随机选择一定数量的序列(由max_seq参数定义),目标序列总是被选中,其余序列则围绕每个选中的序列使用汉明距离进行聚类。AF2利用这些聚类中心和每个聚类中的一个样本(样本长度由extra_seq定义)进行推断(图2)。之前的研究表明,将max_seq和extra_seq的值从其默认值显著降低,可以实现一系列模型系统的集合预测。受这些观察结果的启发,作者开始通过系统测试不同AF2参数组合的准确性,以预测Abl1激酶核心的结构集合。这种蛋白的动态特性有着广泛的文献记录。Abl1被认为存在三种主要构象,各有不同的群分布。在溶液中,Abl1主要以活性(基态)状态存在。不经常地,Abl1会切换到非活性状态1(I1),然后是非活性状态2(I2),后者与Gleevec有很强的结合力。虽然从基态到I1状态的变化是微妙的,但从I1到I2状态的转变涉及到相当大的骨架重排如图3所示。

图 4
为了鼓励AF2生成Abl1所有可能构象的完整集合,作者首先使用JackHMMR算法编译了一个覆盖超过600,000个序列的广泛的多序列对齐(MSA),这些序列来自于野生型Abl1激酶。该算法通过查询UniRef90、Small BFD和MGnify数据库中的序列来构建MSA。随后对每个测试运行了32次预测,每次预测使用独立种子,并在推断过程中启用dropout来从模型的不确定性中抽样。Dropout率与其他研究中发现能改善抽样的率相同(对于Evoformer模块是10%,对于结构模块是25%)。所有其他参数保持默认设置(每次预测循环3次,每个种子5个模型,每次运行总共160次预测,3次独立运行使用唯一种子,每次测试480次预测)。作者发现一个max_seq:extra_seq值为256:512的设置能带来最多样化的结果,特别是在激活环构象方面。重要的是,通过上述参数设置的AF2预测出的激活环构象集合分布在Abl1从基态到I2状态的转变中,没有预测结果显著偏离已知激活环构象的边界,也没有明显不符合物理规律或错误折叠的预测。作为进一步验证模型实际上是在预测转变过程中的构象这一说法的测试,作者将160次子样本的AF2 Abl1预测的集合与从I1到I2过渡轨迹中提取的代表性快照进行了比较(详情见原论文附录讨论部分),这个轨迹是通过对溶液中的无配体Abl1进行增强采样的MD模拟生成的(对比见图4)。尽管预期会观察到一系列构象,但激活环转变的覆盖范围是值得注意的,并且表明了使用AF2采样中间状态,揭示路径和机制的可能性。
AF2在预测构象分布方面的潜力

图 5

图 6
作者接下来研究了AF2在预测构象分布方面的潜力。作为一个基本的合理性检验,作者测试了Abl1的预测结果是否真的是AF2解码有关相对状态群的共进化信号的产物,还是仅仅一个幸运的巧合。因此作者预测野生型Src激酶的相对状态群(见图5)。如果关于抽样AF2潜力的假设确实正确,则能预期该方法将输出显著更多的基态预测。据此作者使用与Abl1相同的程序为Src激酶核心(残基235-497)序列构建了一个大型MSA,并以此为输入运行AF2。然后测量了Src激酶核心基态和I2状态的相对群分布。结果发现来自抽样AF2的大多数Src激酶核心预测都处于基态,与Abl1的89%相比,预测的相对状态群为97%,如图6所总结。有趣的是,虽然已知该酶偶尔会占据I2构象,但没有任何Src的预测被发现处于I2状态。这表明使用AF2预测相对状态群存在一个分辨率限制:在当前实现中,像Src中的I2这样占据率非常低的构象可能会被算法遗漏。这一限制的潜在原因是AF2的预测模型是基于直到2018年为止存储在PDB中的所有结构训练的,而且AF2训练集中的Src及其同源物的大多数结构都处于基态。作者预期,对AF2及类似的AI方法进行微调或重新训练,使用代表给定蛋白质域不同构象状态的显著更多样化的结构数据集,可能是提高预测该域构象可塑性的分辨率和准确性的可行策略。此外,使用更深层的MSA进行训练也能提高预测准确性。
使用AF2预测激酶等位基因系列的构象变化
尽管对Abl1到Src进化线获得的结果充满希望,但更有影响力的应用将是预测等位基因系列中状态群的变化如何发生。这是因为许多蛋白质中的点突变被认为通过改变构象景观和相对状态群来导致不同的表型——例如药物抗性。为了衡量抽样AF2填补这一需求的能力,作者使用一系列具有良好特性和对基态及I2状态的相对群有显著影响的Abl1单点和双点突变重复了预测,并将结果与野生型预测结果进行了对比。具体来说四种预期会降低基态群的突变(M290L, L301I, F382V, M290L + L301I)和四种预期会增加基态群的突变(E255V, T315I, F382L, E255V + T315I)上测试了这种方法。它们在Abl1中的位置以及它们对基态群的预期影响总结在图5中。值得注意的是,抽样AF2正确预测了超过80%的测试案例中相对状态群的变化及其方向。尽管这些结果令人充满希望,但并非没有问题。首先,M290L的预测不准确。具体来说,突变对基态群的影响与实验中观察到的相反。其次,预测的准确性仅在定性意义上适用,因为已知能显著增加基态群的双点突变,如M290L + L301I,被抽样AF2预测仅比单点突变如M301I略微增加。作者认为这种不准确直接导致错误的M290L预测的结果,这也应该导致包括M290L在内的双点突变效果的低估。
编译 | 曾全晨
审稿 | 王建民
参考资料
Monteiro da Silva, G., Cui, J.Y., Dalgarno, D.C. et al. High-throughput prediction of protein conformational distributions with subsampled AlphaFold2. Nat Commun 15, 2464 (2024).
https://doi.org/10.1038/s41467-024-46715-9