Cell. Rep. Med. | scRank利用靶标干扰的基因调控网络推断药物应答细胞类型
Cell. Rep. Med. | scRank利用靶标干扰的基因调控网络推断药物应答细胞类型

DRUGAI
今天为大家介绍的是来自浙江大学范骁辉团队的一篇论文。由于细胞群体之间的异质性,细胞对药物的反应存在分歧。因此,识别对药物有反应的细胞群体对于准确阐明药物作用机制至关重要,但这仍然是一个巨大的挑战。作者在这里通过scRank解决了这个问题,scRank采用目标扰动的基因调控网络,通过使用未经处理的单细胞转录组数据进行计算机模拟药物扰动来对药物响应的细胞群体进行排序。作者在模拟和真实数据集上对scRank进行了基准测试,显示出scRank优于现有方法的优异性能。当应用于髓母细胞瘤和重度抑郁症的数据集时,scRank识别出的药物响应细胞类型与文献一致。此外,scRank准确揭示了响应丹参酮IIA的巨噬细胞亚群及其在心肌梗死中的潜在靶点,并通过实验验证。总之,scRank能够使用未经处理的单细胞数据推断药物响应的细胞类型,从而提供对治疗干预在细胞水平上有影响的见解。

细胞细胞对药物的反应存在显著异质性,这是由于细胞群体的多样性导致的。在不同细胞的特定生物网络中,药物与其靶点的相互作用会产生不同的效果,因此理解药物反应的异质性需要表征复杂组织中的细胞亚群。单细胞RNA测序(scRNA-seq)的进展使得在单细胞水平上描绘细胞异质性成为可能,这为药物开发策略从靶向特定因素转向靶向关键细胞类型提供了基础。
然而,识别对药物治疗有反应的关键细胞类型仍然是一个重要挑战。现有方法往往忽视了药物靶点的先验知识,并且需要疾病-治疗配对数据集,这限制了它们在仅包含疾病状态的现有数据集中的应用。随着疾病状态数据的日益丰富,仅从未经处理的数据集中推断对治疗有反应的关键细胞类型具有重要意义。
为此,作者提出了scRank,这是一种使用目标扰动的基因调控网络(tpGRN)在未经处理的scRNA-seq数据中模拟和评分药物扰动的药物反应细胞类型推断方法。scRank通过删除GRN中的药物靶基因节点来模拟药物效果,并使用流形对齐算法和网络扩散评估扰动效应。广泛的模拟和实际数据验证显示,scRank能够成功识别药物靶向的细胞类型,并且其性能优于其他现有方法。
模型框架
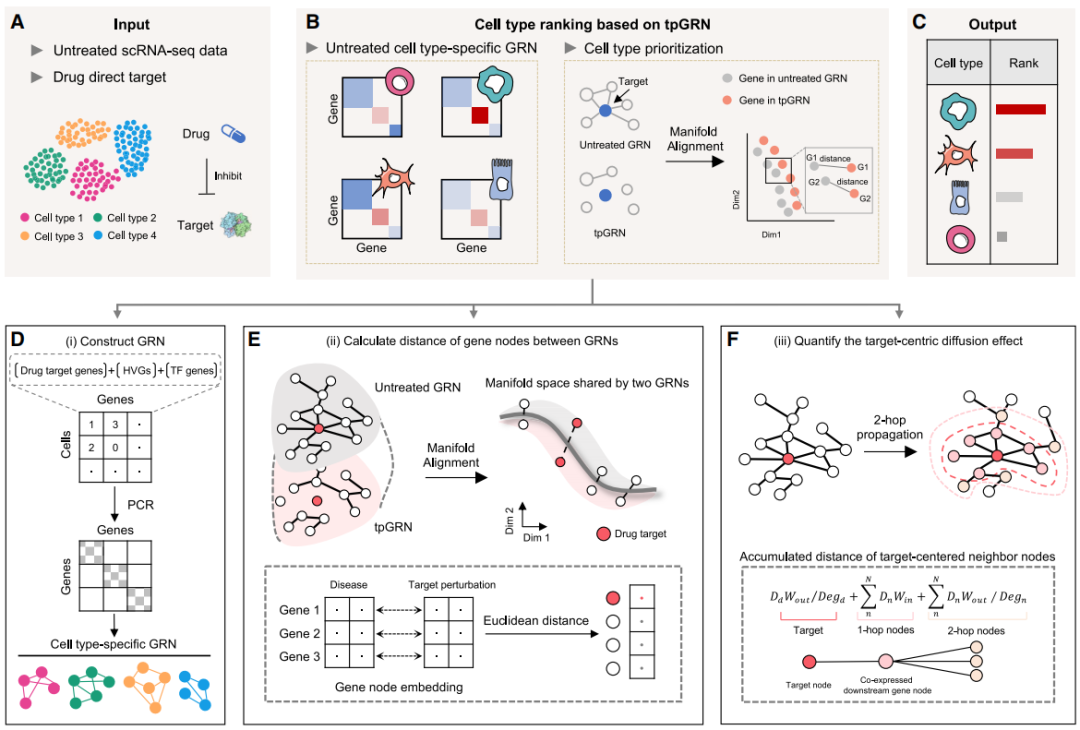
图 1
作者提出了scRank,它用于基于细胞类型对指定药物的潜在基因网络活性进行排序。一般来说,scRank以单细胞转录组数据和感兴趣的药物直接靶点作为输入数据,输出药物反应细胞类型的排序(图1A)。输入数据仅包括来自疾病状态的未经处理的表达计数矩阵,以及用于执行计算机模拟药物扰动的药物直接靶点对应的基因名称。通过比较每种细胞类型在未经处理和药物靶点扰动后的基因调控网络(GRN),利用流形对齐和网络扩散评估药物扰动(图1B)。输出的扰动评分表示细胞类型对药物反应的程度(图1C)。
为了保留疾病状态的主要特征,并整合尽可能多的生物过程和药物靶基因以高效构建GRN,作者仅考虑了有限的表达相关特征,即前2000个高变异基因(HVGs)、转录因子和药物靶基因。在实际操作中,HVGs使用Seurat确定,转录因子来自AnimalTFDB,药物靶基因来自DGIdb,并作为输入基因特征集成以构建GRN(图1D)。
为了对药物反应细胞类型进行排序,首先生成tpGRN,通过将未经处理的GRN中靶基因的边权重设为零来模拟抑制剂效应(图1E)。为了考虑局部扩散,即扰动效应将通过与靶基因共同表达的边沿着下游基因扩散,作者考虑了2跳邻域扩散并对其效果进行评分(图1F)。
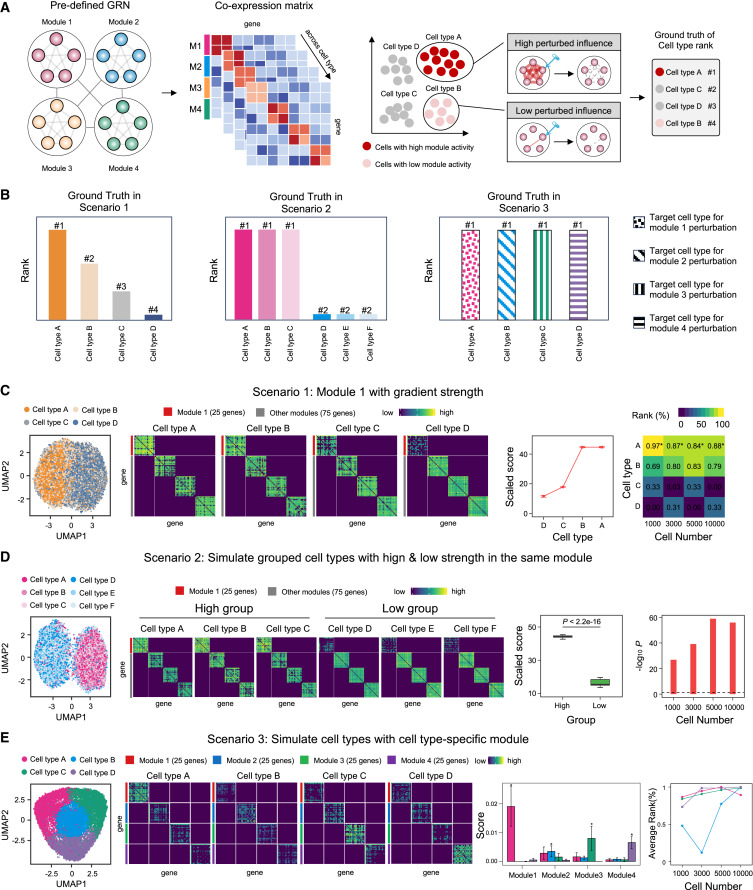
图 2
作者假设如果药物的靶基因位于高活性疾病模块内,那么药物的扰动效应在细胞网络中会更显著。因此,具有活性靶基因的细胞类型应对这种扰动表现出更强的反应,从而形成细胞类型排序的真实值(图2A)。具体而言,作者开发了三种不同的情境,每种情境都有一个定义的药物反应细胞类型的真实排序(图2B)。这种方法使作者能够在不同情况下评估模型的预测准确性。
在情境1中,作者模拟了四种细胞类型的scRNA-seq数据集,展示了基因模块1的活动逐步增加,以说明常见的疾病进展模式(图2C)。结果表明,scRank通过扰动模块1中的基因成功识别了细胞类型,并在大多数情况下将细胞类型A排序在最高位置,且细胞数量不断增加。
在情境2中,模块1的展示不是线性增加,而是以二进制方式表现为两组细胞类型(图2D),反映了一种不同的疾病模式。结果表明,scRank也能够区分基因模块1中的“高组”和“低组”,每种情况下都有显著差异。
在情境3中,基因模块以细胞类型特异性方式表现(图2E),这对于理解不同细胞类型之间的差异药物反应至关重要。每种细胞类型都有一个特定的高活性基因模块,然后迭代地扰动了模块1到4的基因。对于每次特定模块基因的扰动,目标细胞类型的扰动评分都大于任何其他细胞类型,并且目标细胞类型的平均排名在大多数情况下是最高的。总体而言,在合成数据集中的验证证明了scRank能够准确地对细胞类型进行排序。
实验结果
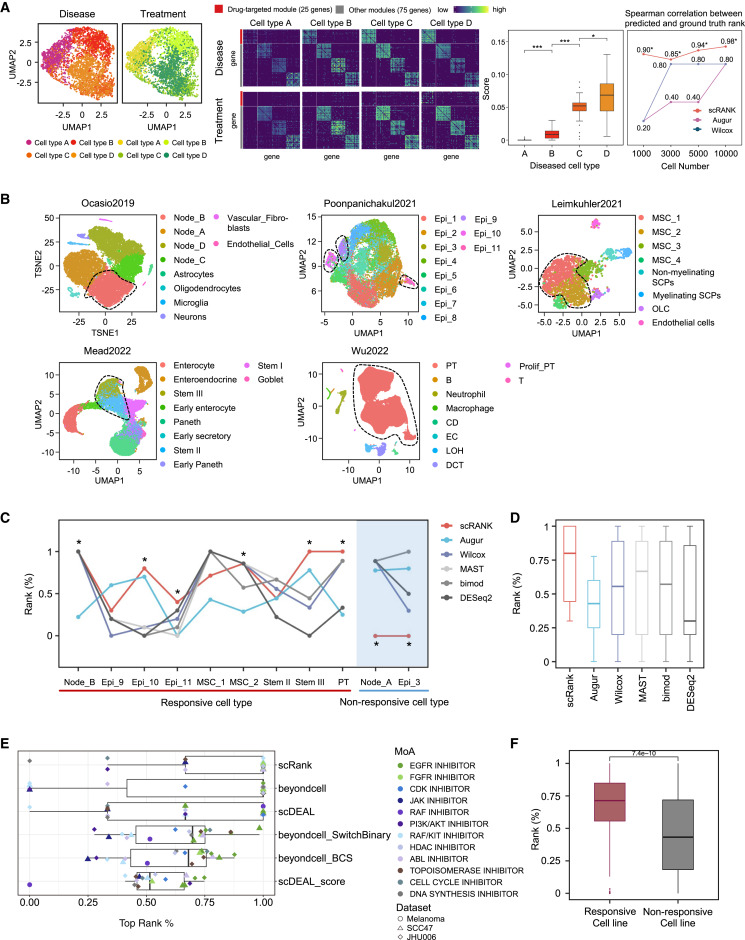
图 3
为了进一步评估scRank在识别药物靶向细胞类型方面的性能,作者将其与现有方法进行了对比。这些方法根据差异表达基因(DEGs)的相对数量或不同条件(治疗前后)下同一细胞类型之间的可分性来优先排序对药物反应最强的细胞类型。为了将scRank与这些方法进行比较,作者首先将它们应用于合成的配对条件数据集(情境4, 图3A)。随着数据集中细胞数量的增加,所有方法的细胞类型排序都与真实情况一致。然而,scRank在使用四个基准数据集且细胞数量增加时表现出稳健的性能,在药物响应细胞类型的推断中优于现有方法。
此外,为了进一步比较scRank在真实scRNA-seq数据集上的性能,作者收集了五个单细胞药物扰动数据集,包含九种已知靶向细胞类型(图3B)。scRank在五个数据集中将九种药物靶向细胞类型识别为排名最高的(图3C),在大多数情况下其排序超过其他方法。此外,scRank将两种非响应细胞类型(用作阴性对照)的排序排在最底部,低于任何其他方法的排序。平均而言,scRank在比较其他方法时,将靶向细胞类型排在较高的位置,表明它能够更准确地从仅包含未经处理条件的数据集中确定药物靶向细胞类型(图3D)。
接下来,作者结合了另外三个癌细胞系scRNA-seq数据,以证明scRank在细胞异质性低的情况下的性能,并使用这些数据集将scRank与药物反应预测工具(如beyondcell和scDEAL)进行比较(图3E)。结果表明,即使在异质性较低的体内样本中,scRank仍然保持优异的性能。此外,作者将scRank应用于Kinker等人的179个不同细胞系的scRNA-seq数据。作者利用每个细胞系的CTRP数据集中的药物敏感性信息,评估scRank在识别53种药物响应细胞系方面的性能。结果表明,scRank适用于各种药物,整体准确率为71.3%(图3F)。
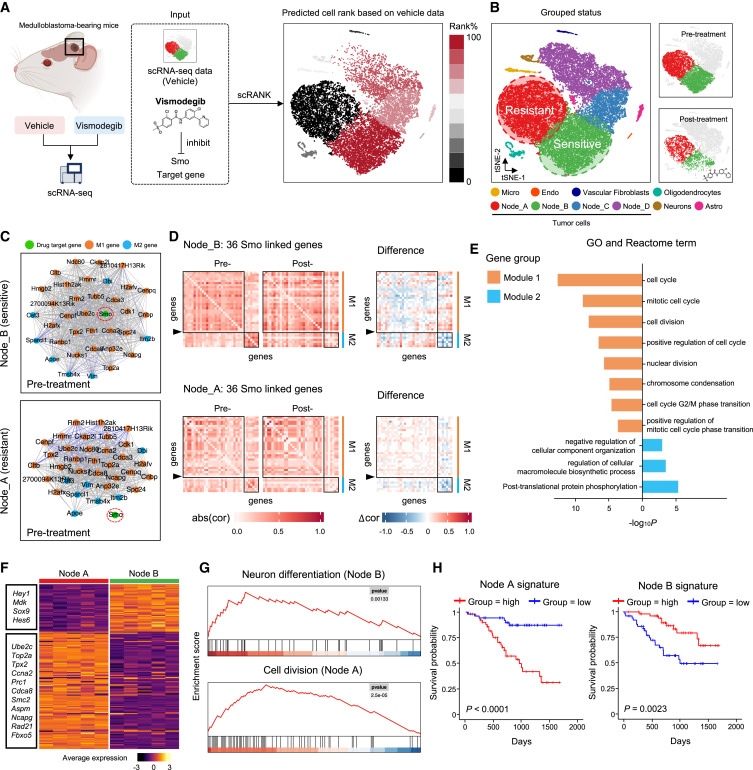
图 4
作为在真实scRNA-seq数据中的基准测试的扩展,作者选择了其中一个基准数据集,该数据集来自患有髓母细胞瘤的小鼠,包含已知的药物敏感和耐药细胞类型,以演示scRank如何识别药物靶向的细胞类型及相关的生物机制(图4A)。基于它们分别具有最高和最低的扰动评分,scRank成功识别出了药物敏感和耐药的肿瘤亚型(Node_B和Node_A),这与原始论文的发现一致(图4B)。
为了阐明髓母细胞瘤对Smo抑制剂视觉反应的分子机制,作者应用scRank重建了两种肿瘤亚型在治疗前状态下的细胞类型特异性基因网络(图4C和4D)。如图4C所示,网络中的基因被分为两个基因模块(M1和M2),药物靶基因(Smo)位于模块1。基因模块1参与细胞周期进程、细胞分裂和G2/M期转换,而基因模块2主要涉及蛋白质磷酸化(图4E)。
为了进一步验证临床样本中预测的SHH抑制剂治疗反应的细胞类型优先级,作者使用两个肿瘤细胞特征对178个人类Sonic Hedgehog亚型髓母细胞瘤(SHH-MB)的批量RNA-seq样本进行评分。作者发现Node_A和Node_B遵循从分裂到分化的连续发展路径。Node_A定义了细胞周期相关基因表达的增殖状态,而Node_B则通过高表达HEY1、MDK、SOX9和HES6定义了分化状态(图4F和4G)。肿瘤表现出更高增殖并可能具有更高Node_A活性的患者预后显著较差(图4H)。与此一致的是,肿瘤表现出更高分化的患者预后显著较好。因此,scRank预测的排名最高的细胞类型确实有望代表治疗靶点。
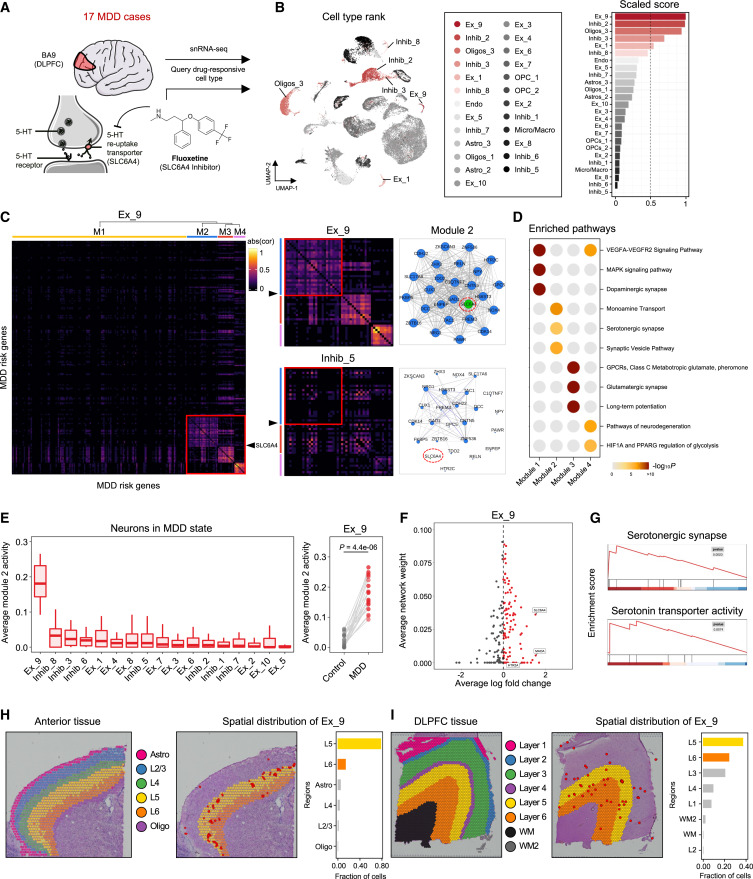
图 5
作者接着考察了scRank是否可以用于识别对选择性5-羟色胺再摄取抑制剂(SSRIs)有反应的细胞类型在重度抑郁症(MDD)中的靶向细胞类型。SSRIs是治疗MDD最常用的药物,通过抑制SLC6A4基因编码的5-羟色胺转运蛋白,阻止5-羟色胺的再摄取,从而增加神经细胞周围的5-羟色胺可用性(图5A)。作者收集了来自健康和未经治疗的MDD人脑背外侧前额叶皮层区域的单核RNA测序(snRNA-seq)数据。在使用未经处理的MDD脑组织中的snRNA-seq数据和SSRI氟西汀的直接靶基因SLC6A4作为输入数据后,scRank对氟西汀反应的细胞类型进行了排序(图5B)。
作者使用scRank检查了最高排名和最低排名的细胞类型的GRN,为了检查与疾病相关的生物过程而只选择了MDD风险基因。Ex_9中的MDD风险基因网络模块化为四个基因模块,其中基因模块2、3和4显示出较高的活性(图5C)。这些基因模块在不同的通路中富集,涉及多巴胺能突触、5-羟色胺能突触、谷氨酸能突触和神经退行性变(图5D)。作者检查了所有神经元亚型中基因模块2的活性,Ex_9在所有神经元亚型中基因模块2的活性始终最高(图5E)。此外,在对照组和MDD组之间,Ex_9中基因模块2的活性显著增加(图5E)。通过比较对照组和MDD组中Ex_9的差异表达基因(DEGs),与治疗SSRI反应相关的基因(SLC6A4、MAOA、HTR2A)的网络权重和表达倍数变化显著上调,能够将Ex_9表征为表现出异常上调的5-羟色胺转运蛋白活性(图5F和5G)。这些结果证明,Ex_9因其与SLC6A4相关的子网络的强激活而促进了MDD的发展,并作为药物靶向的细胞类型。
最近的研究表明,SLC6A4基因主要在前额叶皮层内层神经元的一个子集中表达,5层和6层的神经元可能是SSRIs的靶点,而内层的神经元表现出异常的神经元大小。因此,作者探讨了Ex_9的空间分布是否与这些发现相一致。通过结合了MDD的scRNA-seq数据与小鼠和人脑的空间转录组数据,作者使用CellTrek恢复了组织切片中Ex_9的空间坐标(图5H和5I)。
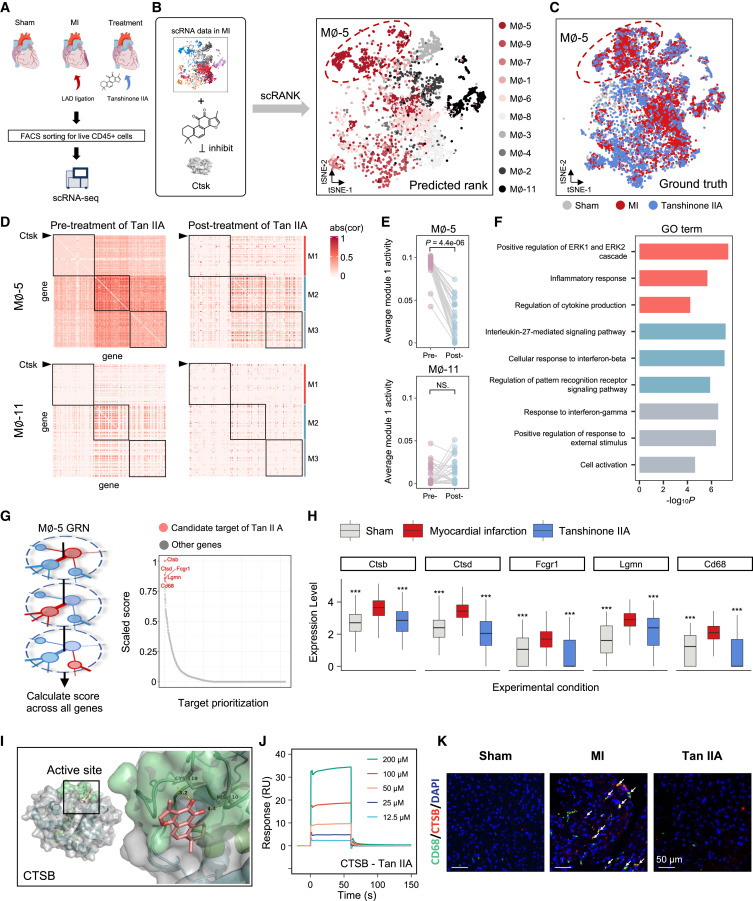
图 6
作者将scRank应用于之前研究中的小鼠心脏巨噬细胞在三种条件(假手术、心肌梗死和丹参酮IIA治疗)下的scRNA-seq数据集(图6A),使用心肌梗死的scRNA-seq数据和丹参酮IIA的直接靶基因Ctsk作为输入数据。如图6B所示,巨噬细胞5(MB-5)是对丹参酮IIA反应最强的细胞类型,这与原始结论一致,即该化合物能显著减少MB-5的比例和炎症效应(图6C)。
然后,作者放大了预测的排名最高和最低的巨噬细胞亚型的Ctsk为中心的子网络,这些子网络基于治疗前条件的数据构建。结果显示子网络被模块化为三个基因模块,药物靶基因Ctsk位于模块1中(图6D和6E)。与MB-11相比,MB-5表现出更高的模块1活性,该模块主要富集于与炎症相关的功能,这通过基因本体分析确定(图6D和6F)。此外,作者观察到丹参酮IIA显著降低了MB-5中模块1的活性,而MB-11中未出现这种情况,这表明MB-5亚群是治疗靶点。
基于丹参酮IIA对基因表达具有抑制作用的假设,作者研究了scRank预测的前五个候选基因是否确实被治疗抑制。结果显示这些基因均显著下调(图6H),作者通过实验也验证了这一点。这些基因在心肌梗死条件下也异常上调,表明这些基因的下调是由于丹参酮IIA缓解了心肌缺血。分子对接结果显示,丹参酮IIA通过与His110和Cys119的氢键相互作用假定结合在CTSB的活性位点(图6I)。为了确认丹参酮IIA与CTSB的结合,作者进行了表面等离子共振分析,发现丹参酮IIA可以直接与CTSB蛋白结合,并且这种结合是浓度依赖的(图6J)。此外,随后的免疫荧光染色实验证实丹参酮IIA显著降低了巨噬细胞中CTSB的表达(图6K)。这些结果与最近的研究相符,表明CTSB可能是丹参酮ⅡA的潜在靶点。
编译 | 于洲
审稿 | 王建民
参考资料
Li C, Shao X, Zhang S, et al. scRank infers drug-responsive cell types from untreated scRNA-seq data using a target-perturbed gene regulatory network[J]. Cell Reports Medicine, 2024.
