准确率超93%!中国科研团队开发自监督AI精准检测弥漫性肺气肿,大幅降低标注依赖 | Cell Press对话科学家
准确率超93%!中国科研团队开发自监督AI精准检测弥漫性肺气肿,大幅降低标注依赖 | Cell Press对话科学家

DrugOne
发布于 2025-12-17 16:43:48
发布于 2025-12-17 16:43:48
交叉学科
Interdisciplinary
12月3日,Cell Press细胞出版社旗下期刊Patterns在线发表题为“A self-supervised framework for emphysema anomaly detection and staging in computed tomography scans”研究论文。这项研究提出了一种创新的自监督学习框架,能够在无需像素级标注的情况下,实现CT扫描中肺气肿的高精度检测与严重程度分级,为大规模早期筛查提供了高效、低成本的自动化工具。
▲长按图片识别二维码阅读原文
文章亮点
- 零像素级人工标注依赖的检测与分级范式:提出了一种自监督学习肺气肿检测与分级框架。该框架仅需非肺气肿样本和合成病灶构成的训练对,在无需任何像素级标注的情况下,即可实现高精度的病灶检测与严重程度分级。
- 针对弥漫性病变的专用网络:设计了一个肺气肿检测与定位网络(EDLNet),通过集成空间-通道细化模块和自适应门控融合机制,有效解决了现有无监督方法难以捕捉肺气肿弥漫性、异质性特征的难题,以及缓解了“identical reconstruction”问题。
- 无监督自动分级:引入了一种基于异常图分数的无监督分级方法,该分数与临床定量常用评估标准(%LAA-950)高度相关,在多中心数据验证中展现出优异的鲁棒性和泛化能力。
文章简介
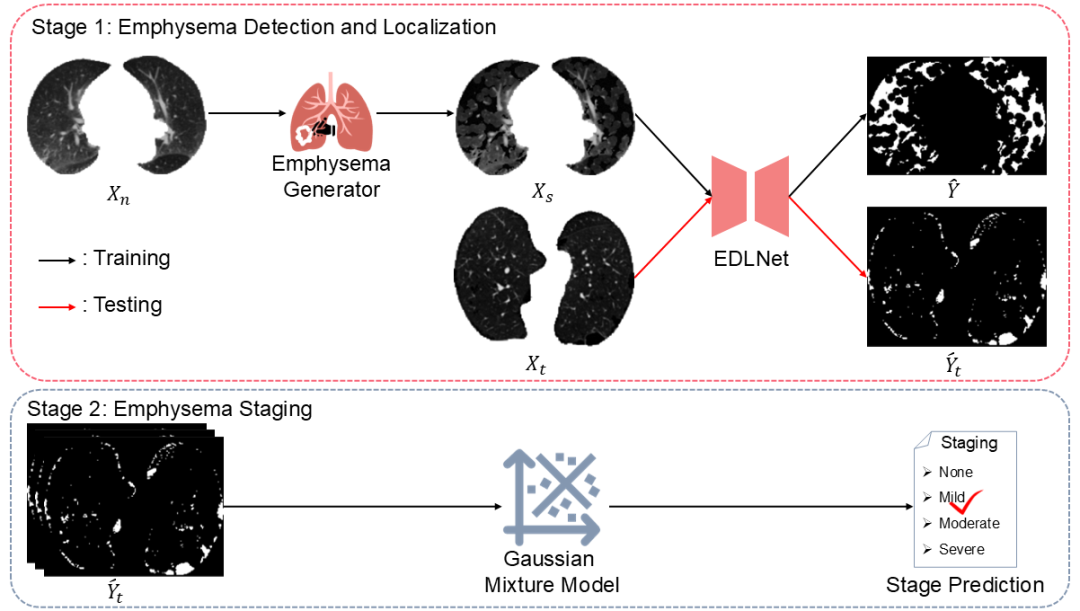
图1 肺气肿检测与分级的整体框架
1.研究背景
慢性阻塞性肺疾病(COPD)已成为全球范围内第三大死亡原因。作为COPD常见的主要表型,肺气肿病变过程不可逆,其不仅会显著加重COPD患者的病情、增加死亡风险,还被证实是肺癌的独立危险因素。尽管肺功能测试(PFTs)是COPD诊断的金标准,但其往往在疾病晚期才能检测到显著异常,难以满足早期筛查的需求。计算机断层扫描(CT)虽可提供高分辨率的肺部成像,但其临床常用的视觉评估法(如Goddard评分)存在主观性强、观察者间变异大、耗时费力等问题。
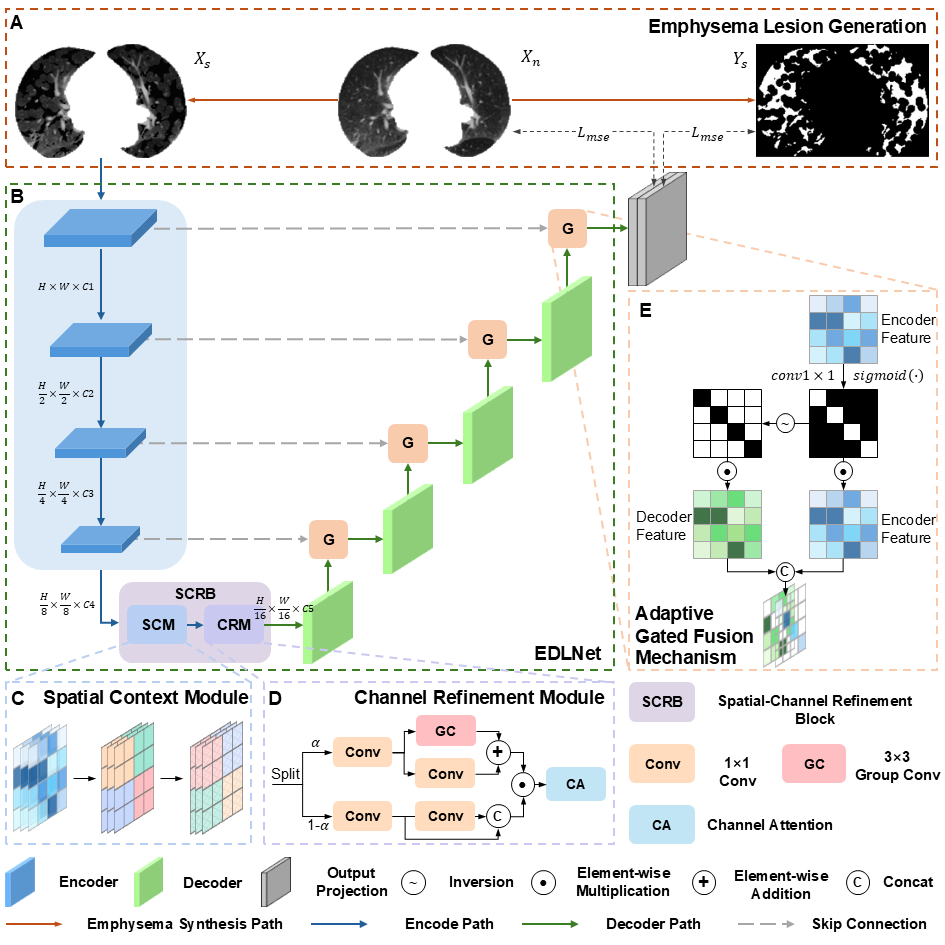
图2 所设计的EDLNet网络架构
近年来,深度学习在医学影像分析中展现出巨大应用潜力,但现有监督学习方法通常依赖于大规模像素级标注数据。然而,肺气肿病灶在肺部呈弥漫性分布,边界模糊且形态高度异质,导致高质量专家标注获取成本极高。无监督异常检测(UAD)凭借仅需正常样本训练的特性,为减少对像素级标注数据的依赖提供了一条可行的解决路径。然而,现有UAD方法多受限于与任务无关的异常合成策略及通用的图像重建模型:前者合成的伪异常难以模拟真实肺气肿的形态学与语义特征,后者则缺乏对肺气肿复杂弥漫性特征的针对性建模。这种合成策略与模型架构的双重局限共同导致了“identical reconstruction”问题(即模型直接复制输入而忽略微小病灶),最终导致肺气肿的漏检或误检。因此,如何在降低对像素级标注数据依赖的同时,设计一种既能精准检测又能分级的自动化工具,是当前肺气肿影像分析亟待解决的关键问题。
2.主要内容和结果
针对上述挑战,本研究提出了一种创新的自监督学习框架,旨在利用非肺气肿CT图像实现肺气肿的自动检测、定位与分级 。该框架主要包含三个核心部分:
(1)基于临床先验的病灶合成策略:为弥补真实标注的缺失,研究团队设计了结合临床先验知识的肺气肿病灶合成策略。该策略以肺气肿的CT值分布为语义指导,在形态学上通过细胞噪声模拟肺气肿的形态学特征,从而在非肺气肿CT图像中合成出形态多样的“伪病灶”。这不仅解决了数据稀缺难题,更在无监督设定下为模型提供了富含语义信息的监督信号。
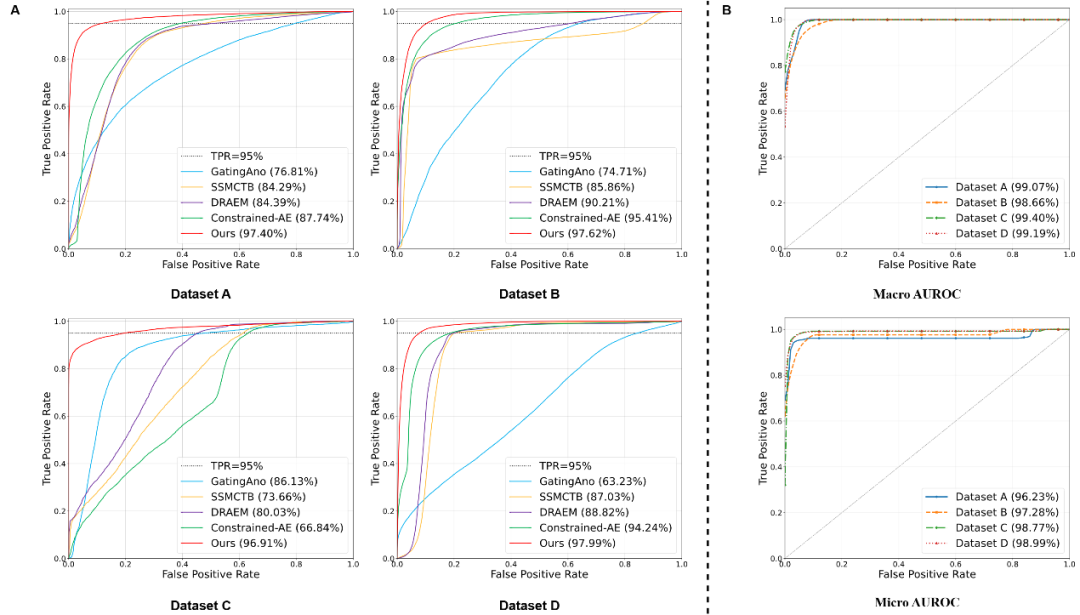
图3 所提出方法在数据集A-D上的肺气肿检测与分级性能
(2)EDLNet:针对现有UAD模型易陷入“identical reconstruction”的局限,本研究设计了专用的编码器-解码器架构EDLNet。该模型集成了空间-通道细化模块,通过增强局部空间上下文和动态校准通道特征来提升对微小病灶的敏感度;同时引入自适应门控融合机制,有效抑制了跳跃连接中的冗余特征干扰并阻断了浅层信息的泄露,从而缓解了“identical reconstruction”,最终提升了病灶检测、定位的精准度。
(3)无监督分级机制:实验结果发现,模型生成的异常图分数与临床常用定量标准(%LAA-950)具有较高的相关性(Pearson相关系数>0.98)。基于此,本研究引入高斯混合模型(GMM)构建自动化分级机制,依据异常图分数将患者精准划分为正常、轻度、中度和重度四种严重程度。
在四个中心数据集(包含两家合作医院数据集和INSPECT、CT-RATE两个公开数据集)上的广泛验证表明,该框架在检测和定位性能上全面优于现有的UAD方法。特别是在分级任务中,该方法实现了93.13%的平均准确率和99.08%的Macro AUROC,展现了较好的鲁棒性和泛化能力。
3.总结和展望
本研究成功构建了一个无需像素级标注的肺气肿检测与分级框架。通过临床先验指导的病灶合成策略和针对性的模型设计,该方法有效克服了“identical reconstruction”和肺气肿弥漫性、异质性带来的检测、定位难题。实验结果表明,该框架不仅在性能上超越了现有的UAD方法,甚至展现出优于少样本监督学习模型的潜力。
在临床应用层面,模型生成的异常图提供了直观的可视化辅助,异常图分数与临床常用定量标准表现出较高的相关性,验证了该方法的临床应用潜力。未来,该技术有望广泛应用于大规模人群的机会性筛查和慢阻肺患者的纵向疾病管理,为疾病的早期发现和干预提供强有力的技术支持。目前模型主要基于2D CT切片,未来的工作将进一步探索3D体数据下的检测、分级框架。
作者专访
Cell Press细胞出版社特别邀请论文作者团队进行了专访,请他们为大家进一步详细解读。
CellPress:
请简要概述这项工作的亮点。
作者团队:
这项工作最大的亮点在于降低了医学影像AI对高成本专家标注的依赖。我们提出了一种“自给自足”的自监督学习范式,仅利用容易获取的非肺气肿CT数据,就能训练出性能较好的肺气肿检测、定位模型。通过临床先验指导的合成病灶,配合专门设计的EDLNet,我们不仅实现了像素级的精准病灶定位,还创新性地利用GMM实现了与临床常用定量标准高度一致的自动化疾病分级。这为大规模人群的肺气肿早期筛查提供了一种高效、低成本的新工具。
CellPress:
研究过程中是否遇到了困难?团队是如何克服并顺利解决的?或是有任何有趣的故事可以与读者分享?
作者团队:
最大的挑战在于肺气肿的病理特征极其特殊。与肿瘤等局灶性病变不同,肺气肿表现为弥漫性的肺实质破坏,其边界模糊且形态极其不规则(即异质性)。这种特性导致现有的通用异常检测方法的效果往往不理想,因为模型很容易“偷懒”,直接复制输入图像而忽略了微小的纹理异常(即“identical reconstruction”问题)。为了克服这一点,我们深入研究了肺气肿的影像学表现,开发了基于临床先验指导的病灶合成策略,使其在语义层面更贴近真实的肺气肿。同时,在模型结构上,我们要平衡“保留背景纹理”和“修复病变区域”的矛盾,为此引入了空间-通道细化模块和自适应门控融合机制,强制模型去学习深层的语义特征而非简单的像素对应,最终成功提升了对弥漫性病灶的捕捉能力。
CellPress:
团队下一步的研究计划是怎样的?
作者团队:
目前的模型主要是基于2D CT切片进行处理的,虽然在纹理捕捉上很敏锐,但尚未充分利用CT扫描的3D体积信息。下一步,我们计划探索3D的模型架构,在保持计算效率的同时引入层间上下文信息,进一步提升检测的连贯性。此外,目前的无监督分级依赖于预设簇数量的GMM模型,未来我们希望引入更复杂的贝叶斯概率模型,以提高在类别不平衡数据中的分级鲁棒性。
CellPress:
最后,是否可以与我们分享一下选择Patterns来发表这个工作的原因?
作者团队:
Patterns作为Cell Press细胞出版社旗下的数据科学期刊,非常强调数据驱动方法的创新及其在解决实际科学问题中的价值。我们的工作正是立足于解决医疗大数据中“标注稀缺”这一核心痛点,通过数据合成与算法设计的结合,实现了临床价值的转化。这与Patterns倡导的愿景高度契合。我们希望通过在这个平台上发表,能让更多计算机科学家和临床医生看到无监督学习在医学影像领域的广阔前景。
相关论文信息
论文原文刊载于CellPress细胞出版社
旗下期刊Patterns,
点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
A self-supervised framework for emphysema anomaly detection and staging in computed tomography scans
▌论文网址:
https://www.sciencedirect.com/science/article/pii/S2666389925002740
▌DOI:
https://doi.org/10.1016/j.patter.2025.101426
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2025-12-06,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读

