Chem. Sci. | 释放 AlphaFold3 类方法在虚拟筛选中的应用潜力
Chem. Sci. | 释放 AlphaFold3 类方法在虚拟筛选中的应用潜力

DrugOne
发布于 2025-12-25 15:03:18
发布于 2025-12-25 15:03:18

在结构生物学与药物发现的交叉领域,AlphaFold3(AF3)的问世不仅颠覆了蛋白质结构预测范式,更将其能力拓展至蛋白质-配体复合物建模,为结构基虚拟筛选(SBVS)提供了全新技术路径。传统分子对接方法长期受限于构象采样不完整、打分函数精度不足及蛋白质柔性模拟缺失等瓶颈,而AF3类共折叠方法凭借序列驱动的复合物结构预测能力,有望突破这些核心限制。
浙江大学团队在《Chemical Science》发表的系统性研究,全面评估了AF3及其开源衍生模型(Protenix、Boltz-2)在虚拟筛选中的应用潜力,通过三大差异化数据集的多维度验证,揭示了该类方法的技术优势、适用边界与优化方向,为其在药物研发中的规模化应用奠定了理论与实验基础。本文将从技术机制、核心发现、实践价值与未来方向四方面,深度解读这一研究。
一、技术背景:从蛋白质结构预测到虚拟筛选的范式迁移
1. AF3类方法的核心技术突破
相较于仅能预测单体蛋白质结构的AlphaFold2,AF3通过生成扩散模型实现了三大关键升级:
- 支持多分子系统建模,可直接预测蛋白质-配体、蛋白质-蛋白质等复合物结构;
- 内置pTM(全局结构精度)、ipTM(界面结构精度)、min-iPAE(最小链间预测误差)等置信度指标,无需依赖外部打分函数即可完成复合物质量评估;
- 序列驱动的预测模式天然适配蛋白质柔性模拟,规避了传统对接中受体刚性假设的局限性。
开源衍生模型Protenix与Boltz-2则在AF3基础上进行了针对性优化:Protenix侧重结构预测的全面性,Boltz-2新增专属结合亲和力预测模块,为虚拟筛选提供更丰富的量化依据。
2. 虚拟筛选的技术痛点与AF3类方法的解决方案
传统SBVS的核心流程是基于三维蛋白质结构与化合物库进行分子对接,通过打分函数排序候选分子,但存在三大难以解决的问题:
- 构象采样覆盖不足,易遗漏配体与蛋白质的最优结合姿态;
- 打分函数难以平衡物理化学特性与生物活性相关性,导致假阳性率偏高;
- 蛋白质柔性处理简化,无法准确模拟生理状态下的分子相互作用。
AF3类方法通过直接预测蛋白质-配体复合物结构,绕过了传统对接的构象搜索步骤,其内置置信度指标基于结构可靠性而非经验性打分,从根本上优化了筛选逻辑。
二、核心研究发现:多维度验证AF3类方法的筛选能力
1. 基准数据集验证:DEKOIS2.0上的性能碾压
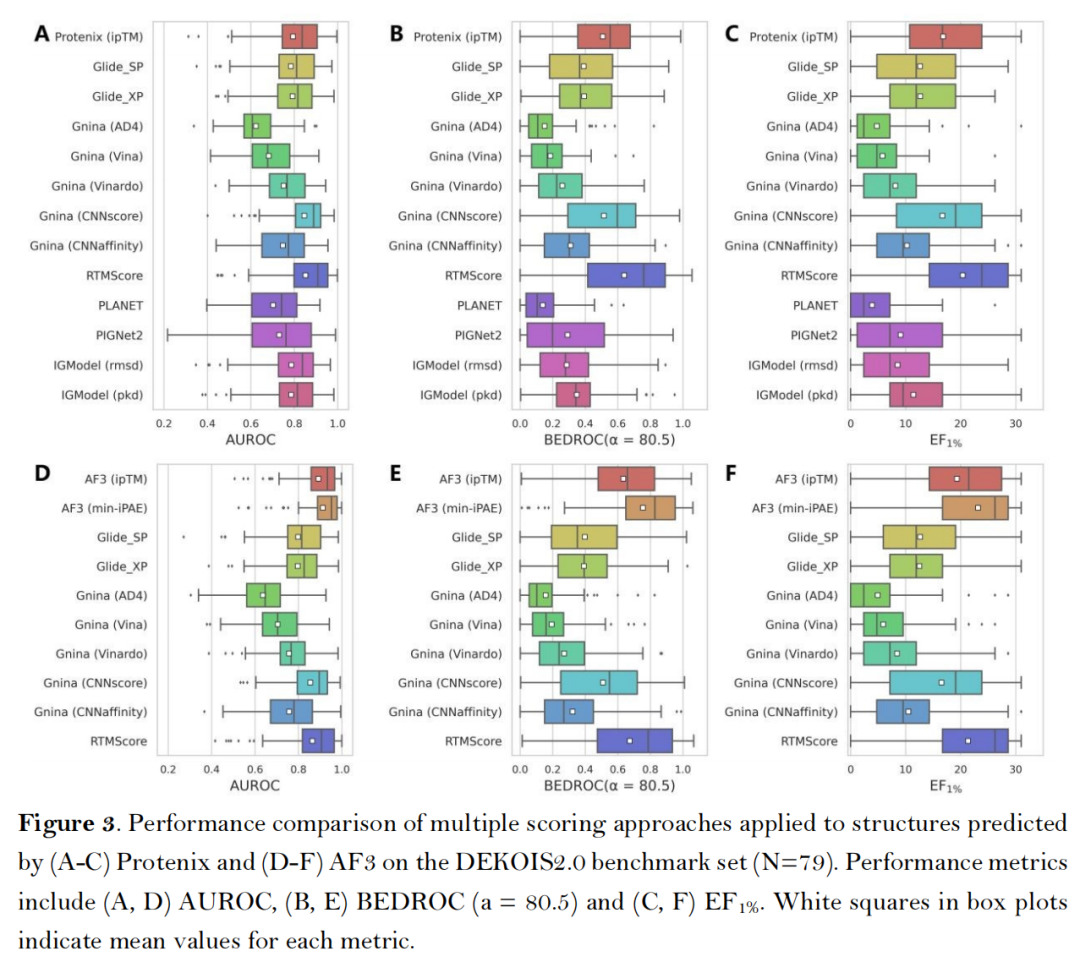
在经典的DEKOIS2.0基准数据集(79个靶点,含实验验证活性化合物与性质匹配诱饵分子,去除了两个P-P界面结合特性靶点)中,AF3类方法展现出卓越性能:
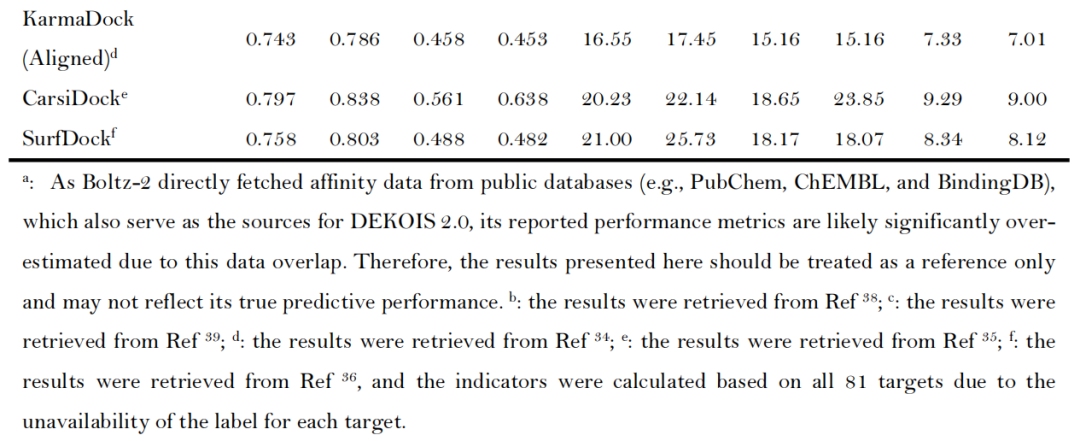
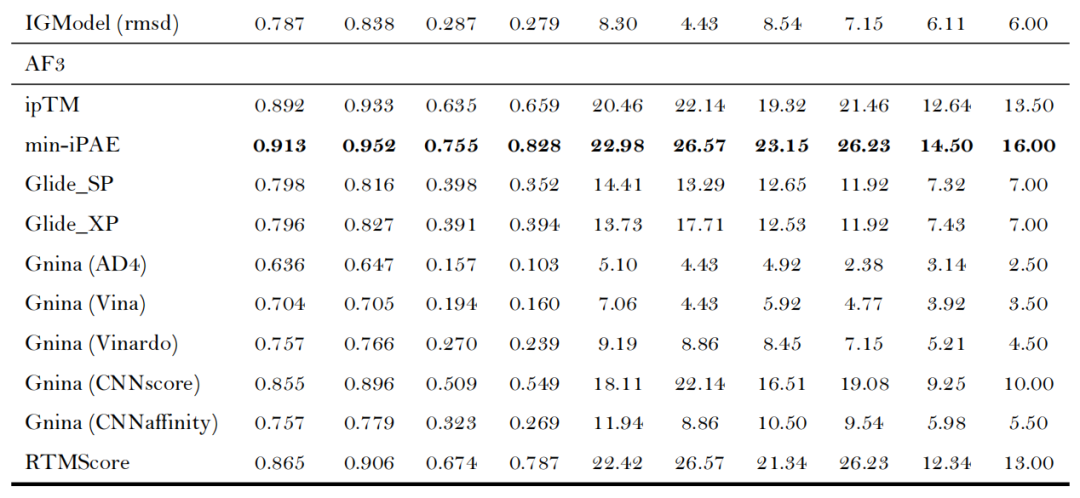
- 核心指标领先:AF3的min-iPAE指标表现最优,平均AUROC达0.913、BEDROC(α=80.5)达0.755、EF₁%达23.15,显著优于传统对接工具(如Glide SP的AUROC 0.745、EF₁% 12.01)及主流AI对接工具(如CarsiDock的AUROC 0.797、EF₁% 18.65)[注:由于Boltz-2团队未发布其具体的训练集,其Affinity模块得到的结果仅供参考];
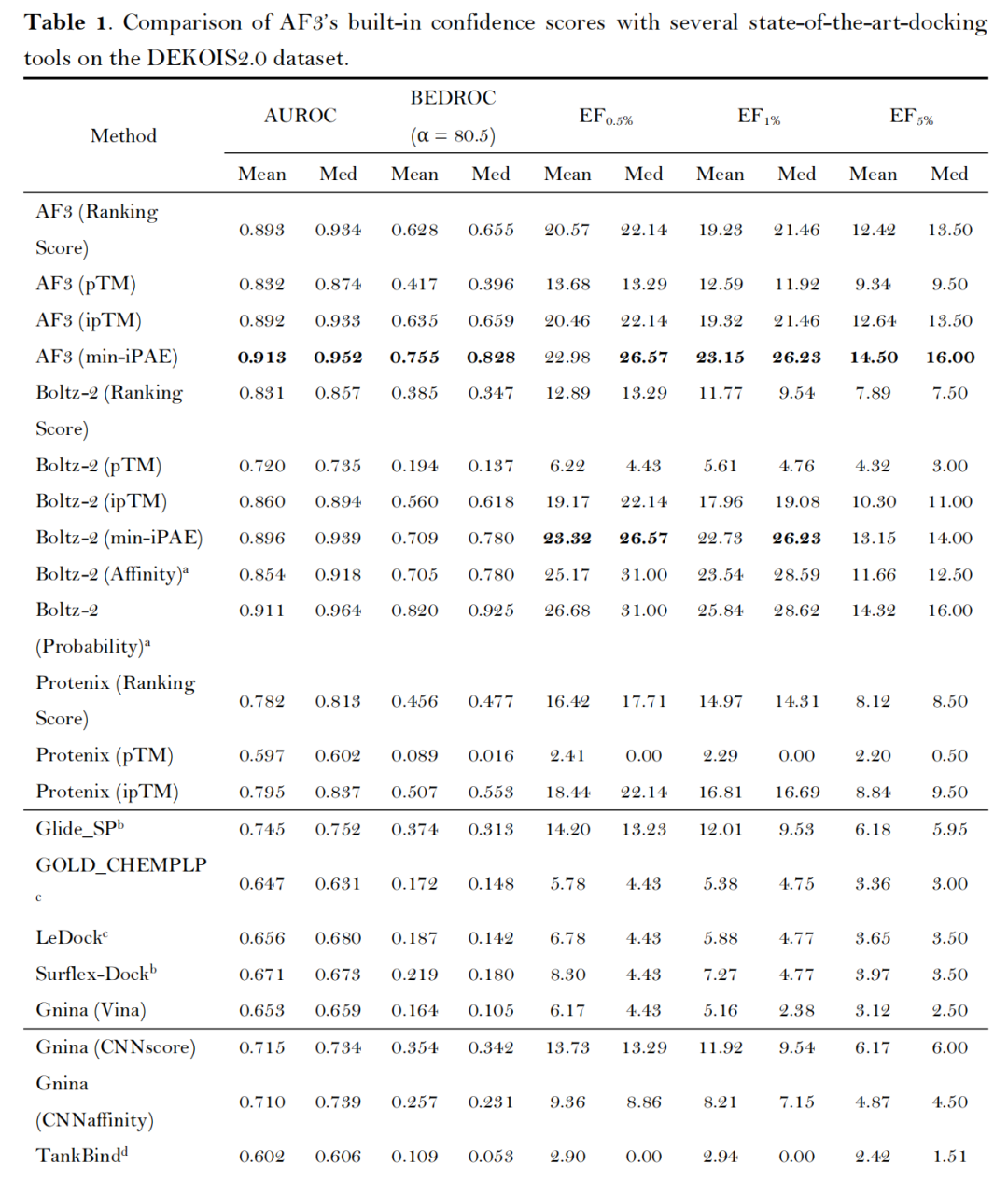
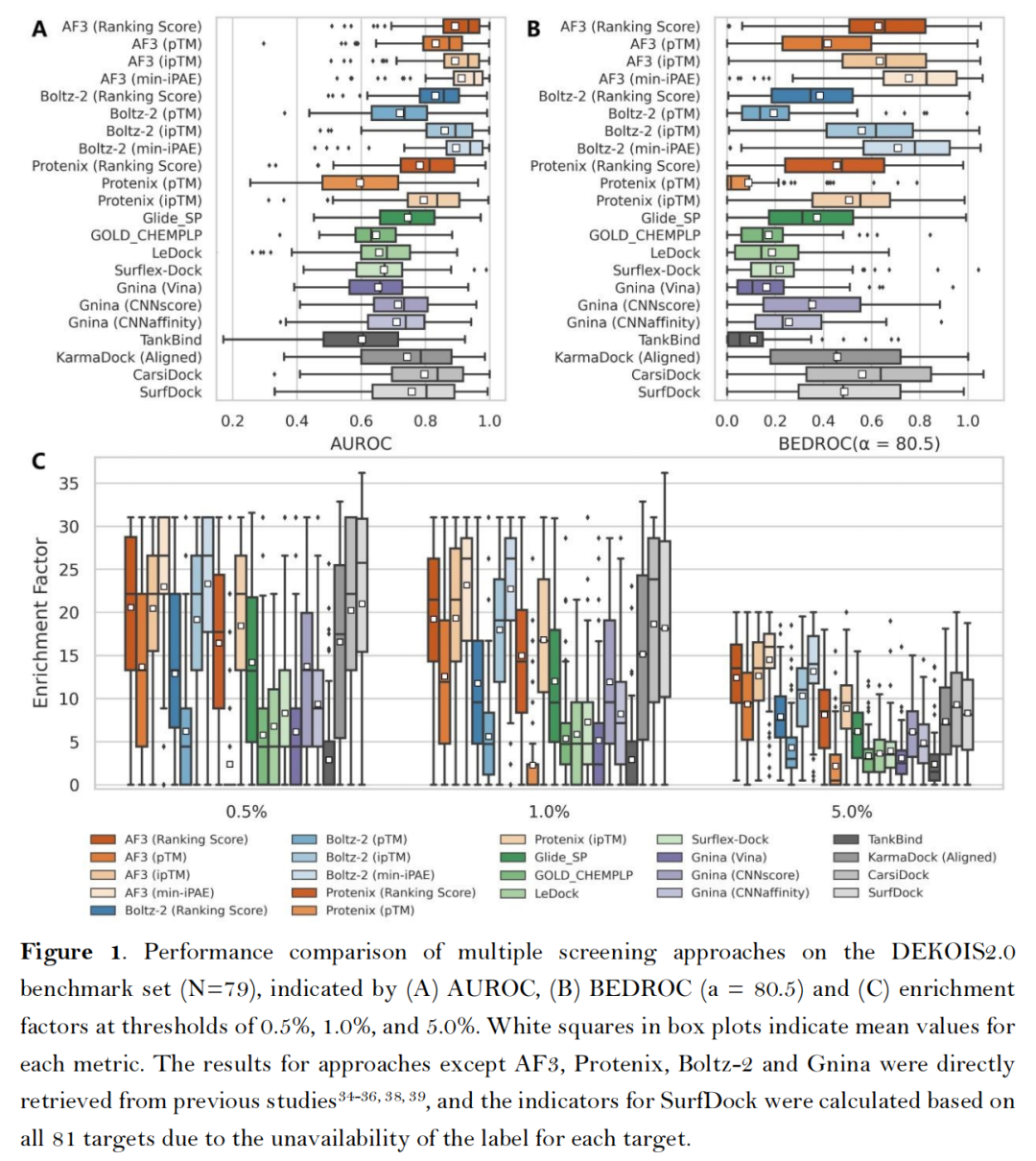
- 置信度指标有效性:ipTM(界面结构精度)与min-iPAE(链间相互作用可靠性)是最优筛选依据,其性能超越复合指标Ranking score及全局结构指标pTM,证实复合物界面结构评估对筛选结果的关键作用;
- 第三方打分函数无增益:Glide、Gnina、RTMScore等外部打分函数未能提升AF3/Protenix的筛选效果,仅CNNscore与RTMScore可接近内置指标性能,印证了AF3类方法结构预测与质量评估的自洽性。
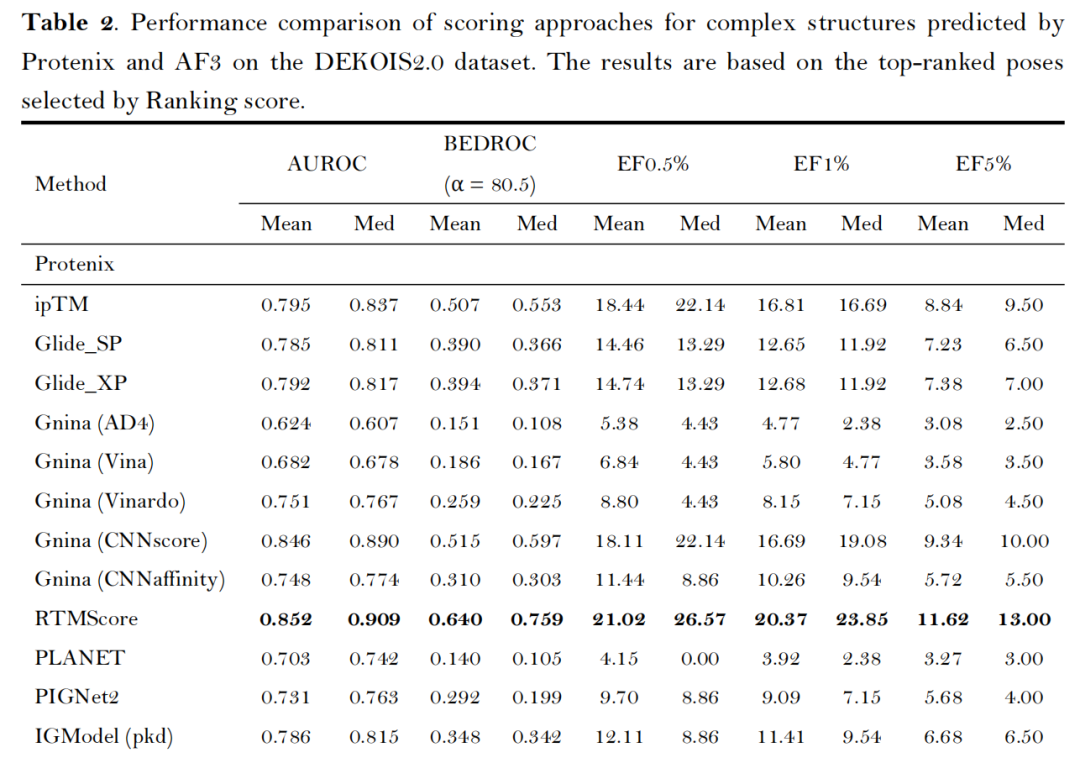
2. 挑战性场景测试:泛化能力与适用边界
为验证方法的真实应用价值,研究设计了三大挑战性场景,揭示了AF3类方法的泛化能力与局限性:
- 配体相似性依赖测试:当逐步剔除与训练集结构相似的活性配体,AF3类方法的AUROC指标呈渐进式下降,但仍显著优于传统工具,且min-iPAE指标对配体结构新颖性的耐受性最强;
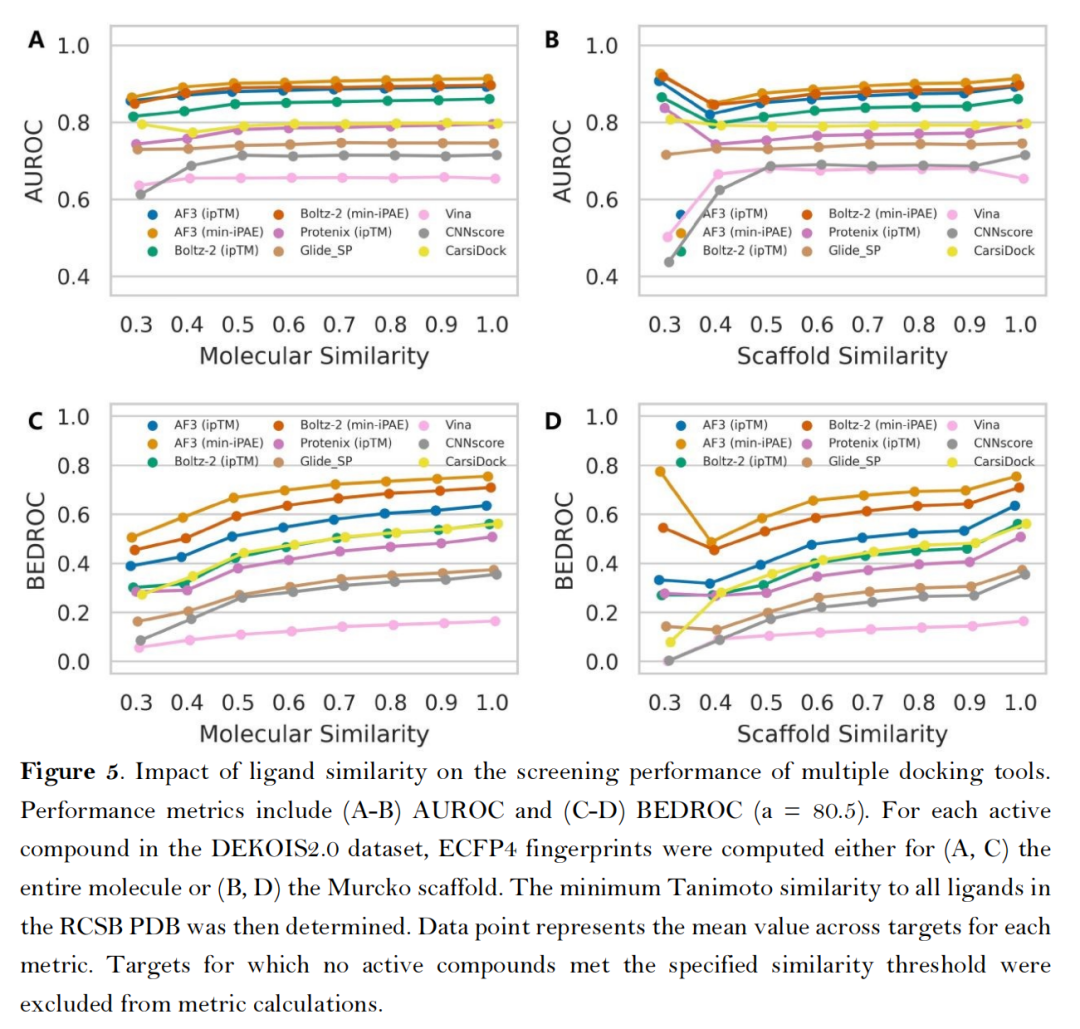
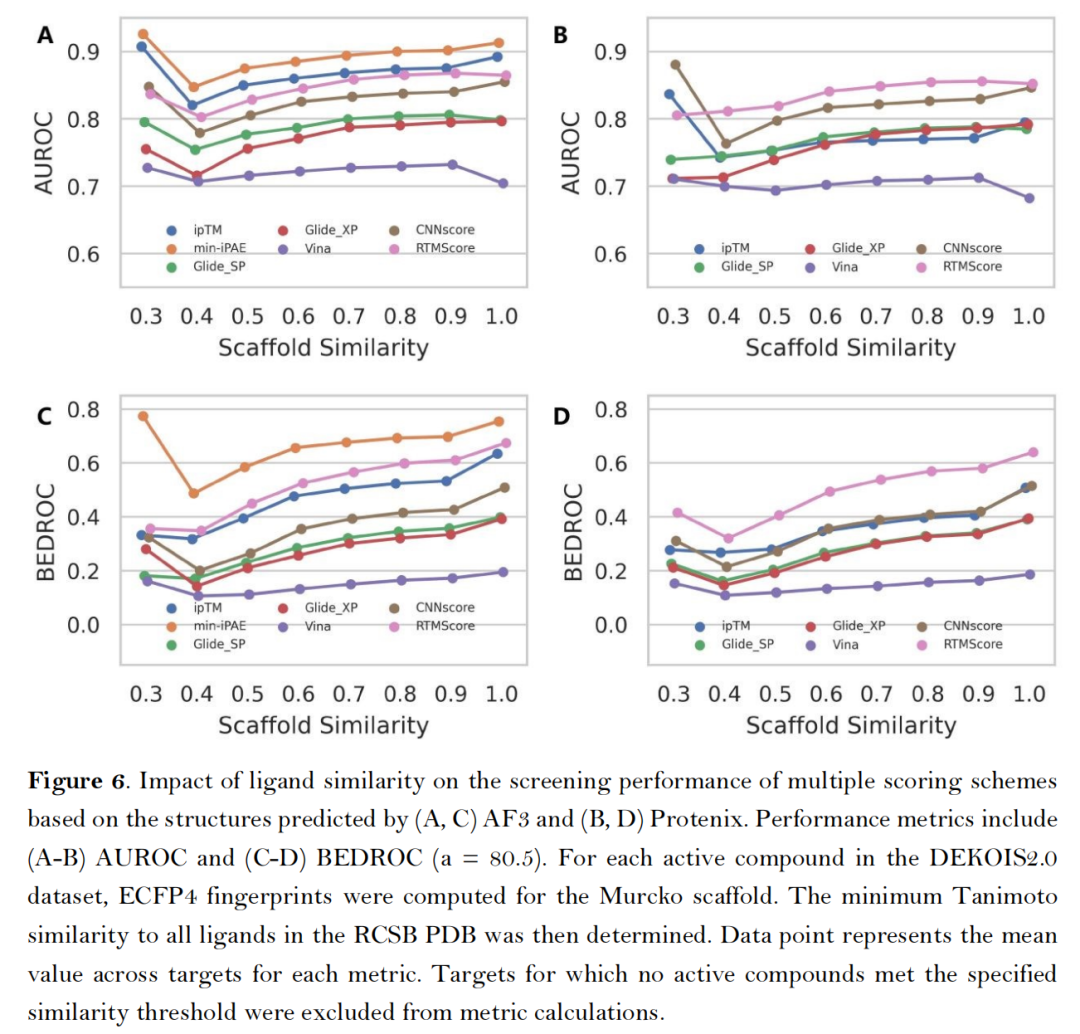
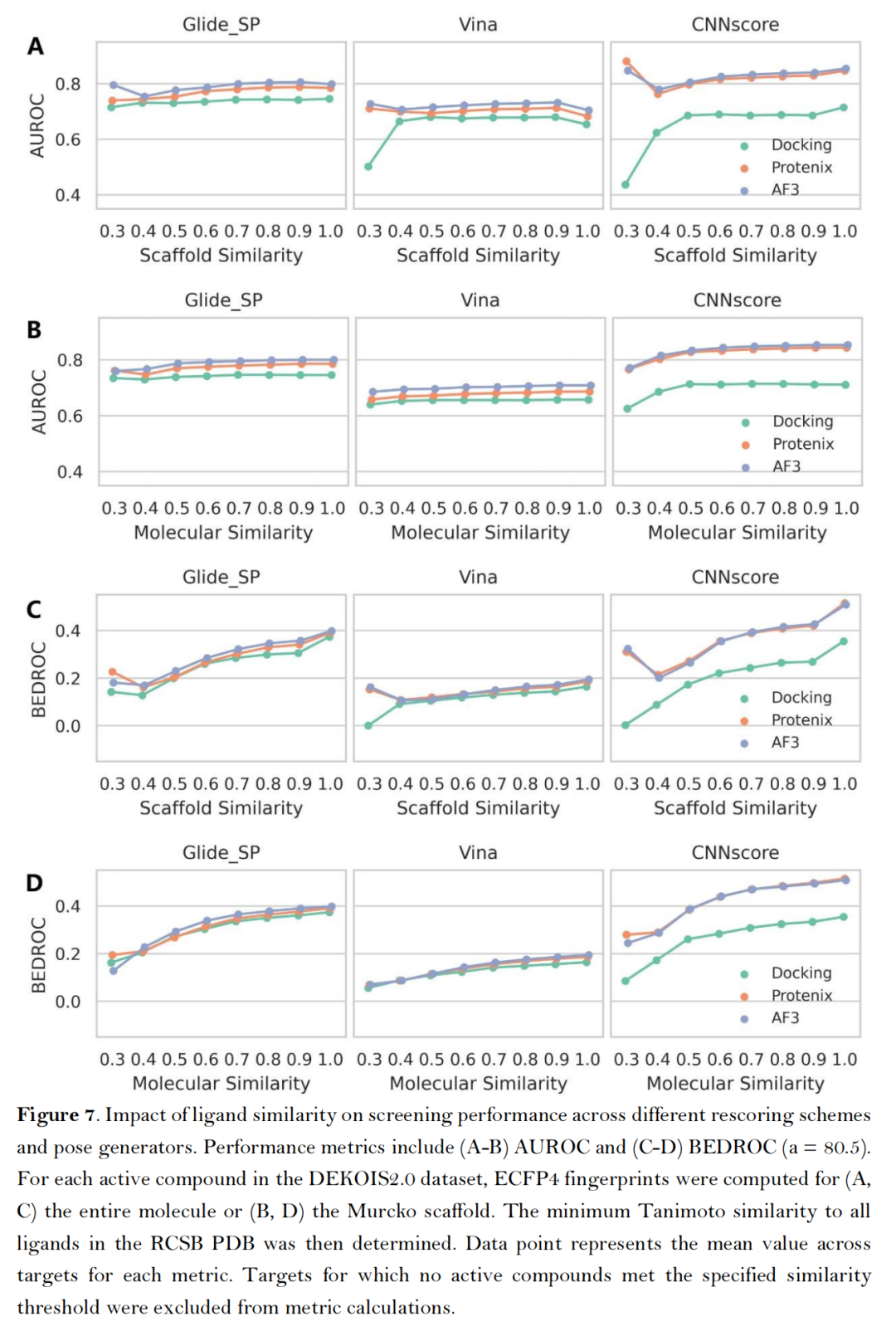
- 由于AlphaFold3显存占用过大,时间较长,后面两个实验没有比较AlphaFold的结果
- 新靶点适应性测试:在2022年后新解析的GPCRrecent数据集(16个靶点)中,Boltz-2的min-iPAE指标仍保持优异表现(AUROC 0.770、EF₁% 13.96),即使在2023年6月后新增的6个靶点子集上,性能依旧稳定(AUROC 0.764、EF₁% 14.30)。【虽然这个有时间限制的数据集可能为主要依赖晶体结构的方法提供了一个补充测试,但Boltz2可能已将几乎所有可用结合数据纳入模型训练,可能结果仍不能反应真实泛化能力】;


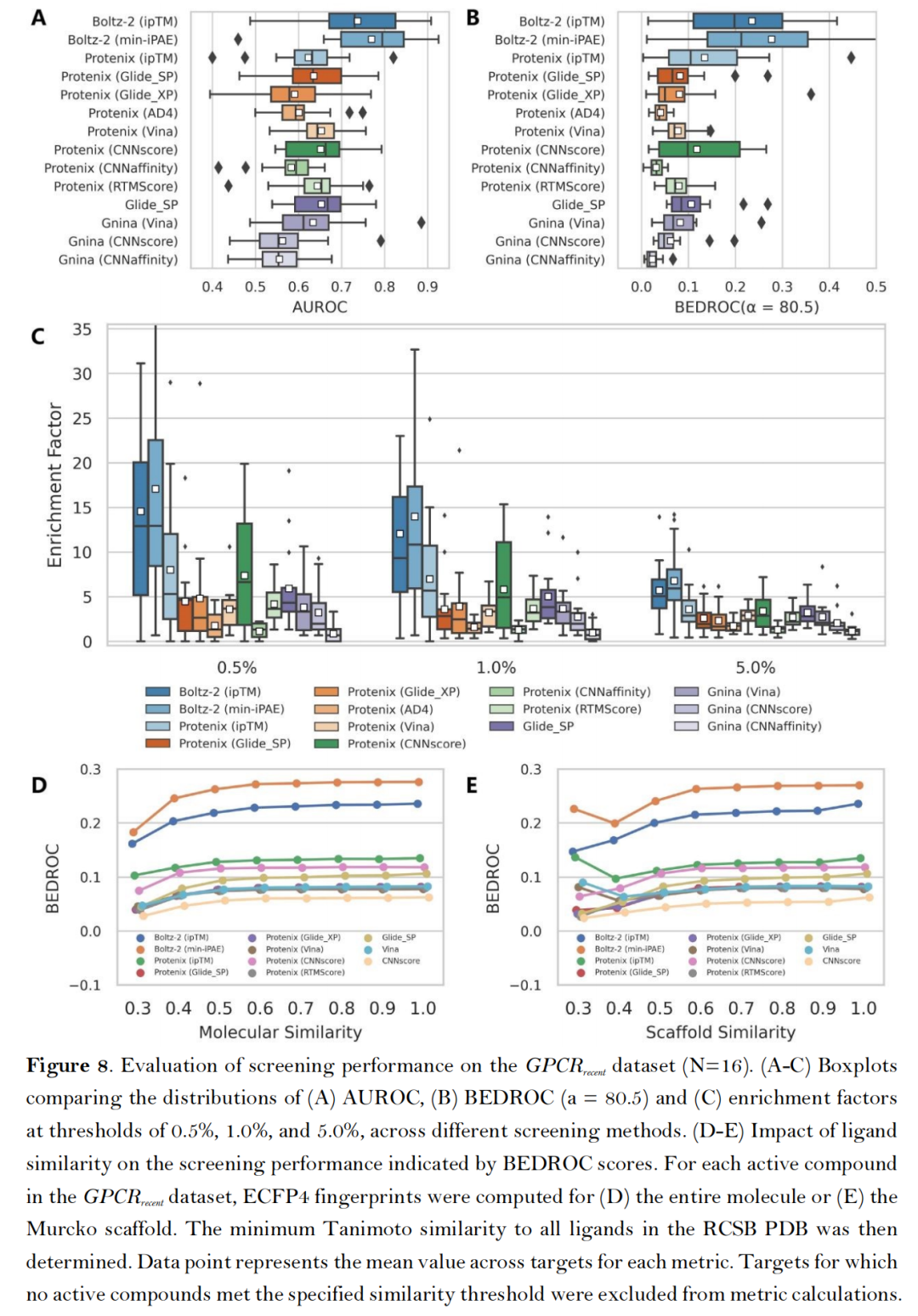
- 真实阴性样本验证:在LIT-PCBA数据集的子集(5个靶点,含实验验证的无活性化合物)中,Boltz-2(min-iPAE)的平均NEF₁%达0.100,显著高于Glide SP(0.079)与Gnina(0.038-0.067),解决了传统数据集人工诱饵分子带来的偏倚问题。
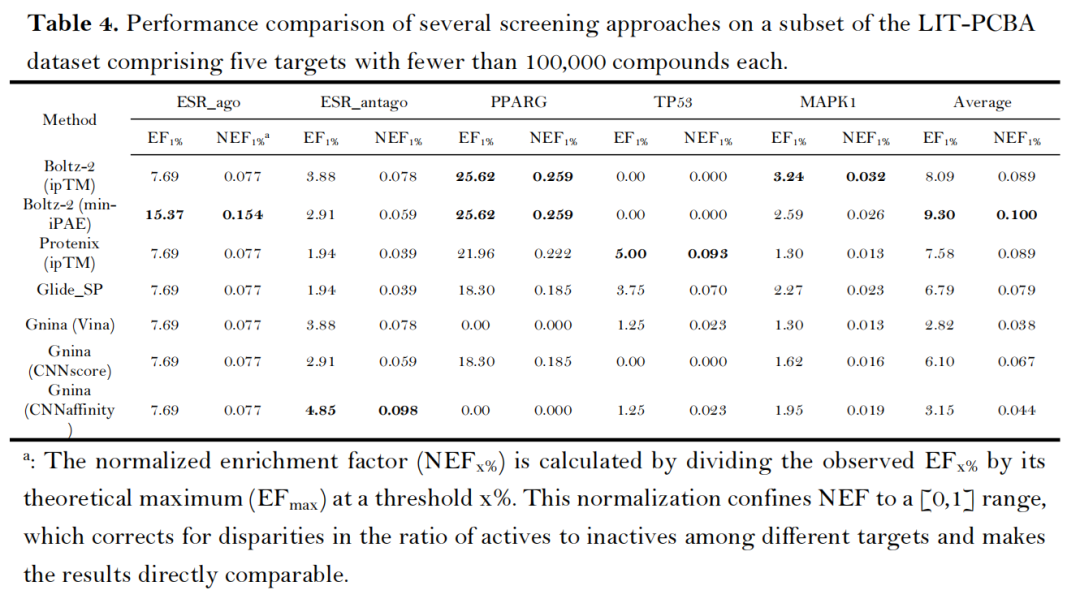
3. 结构可靠性与计算效率:实践应用的关键考量
- 构象物理合理性:AF3/Protenix/Boltz-2预测的复合物构象中,仅0.27%-0.43%存在严重结构异常(无法通过Protein Preparation Wizard处理),经PoseBusters工具验证,97%以上构象符合物理规则。
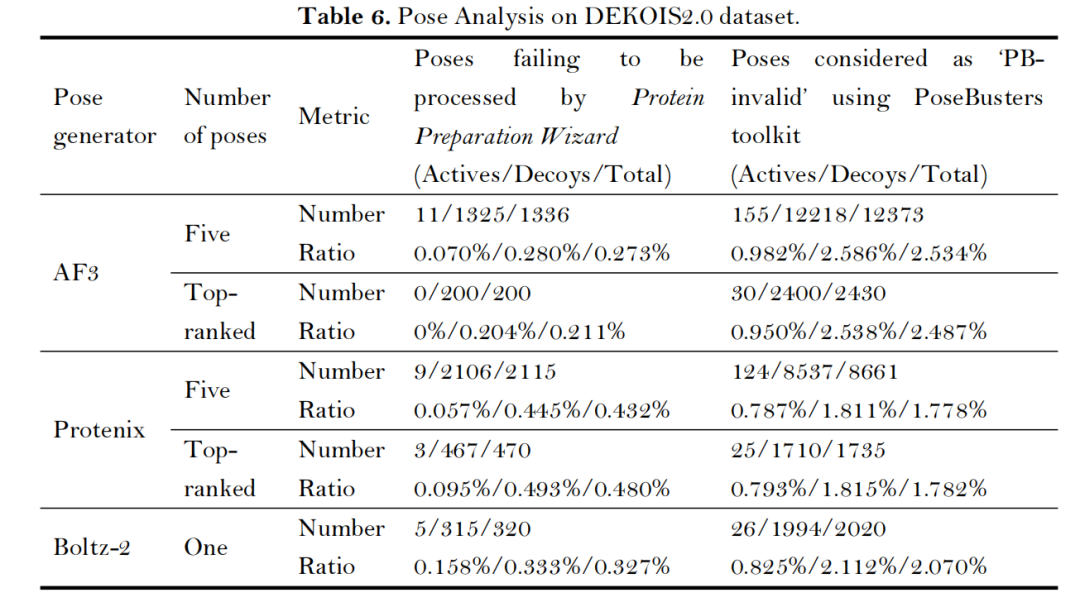
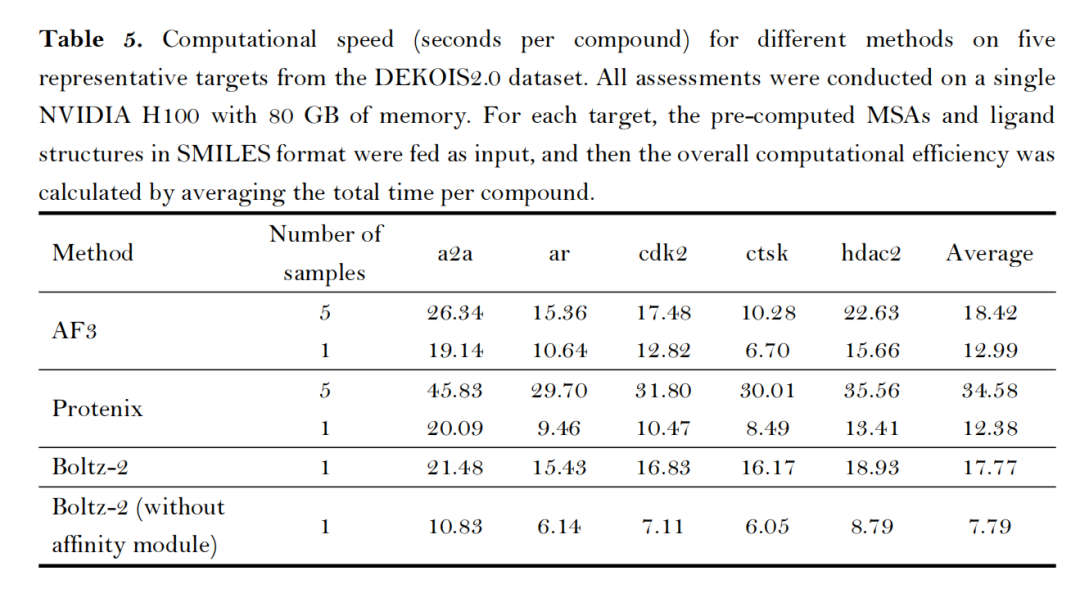
- 计算效率平衡:在NVIDIA H100 GPU上,AF3生成5个构象需18.42秒/化合物,Protenix需34.58秒/化合物,Boltz-2(关闭亲和力模块)最快仅需7.79秒/化合物;内存占用方面,Protenix与Boltz-2仅需5GB,远低于AF3的60GB,更适合大规模筛选场景;
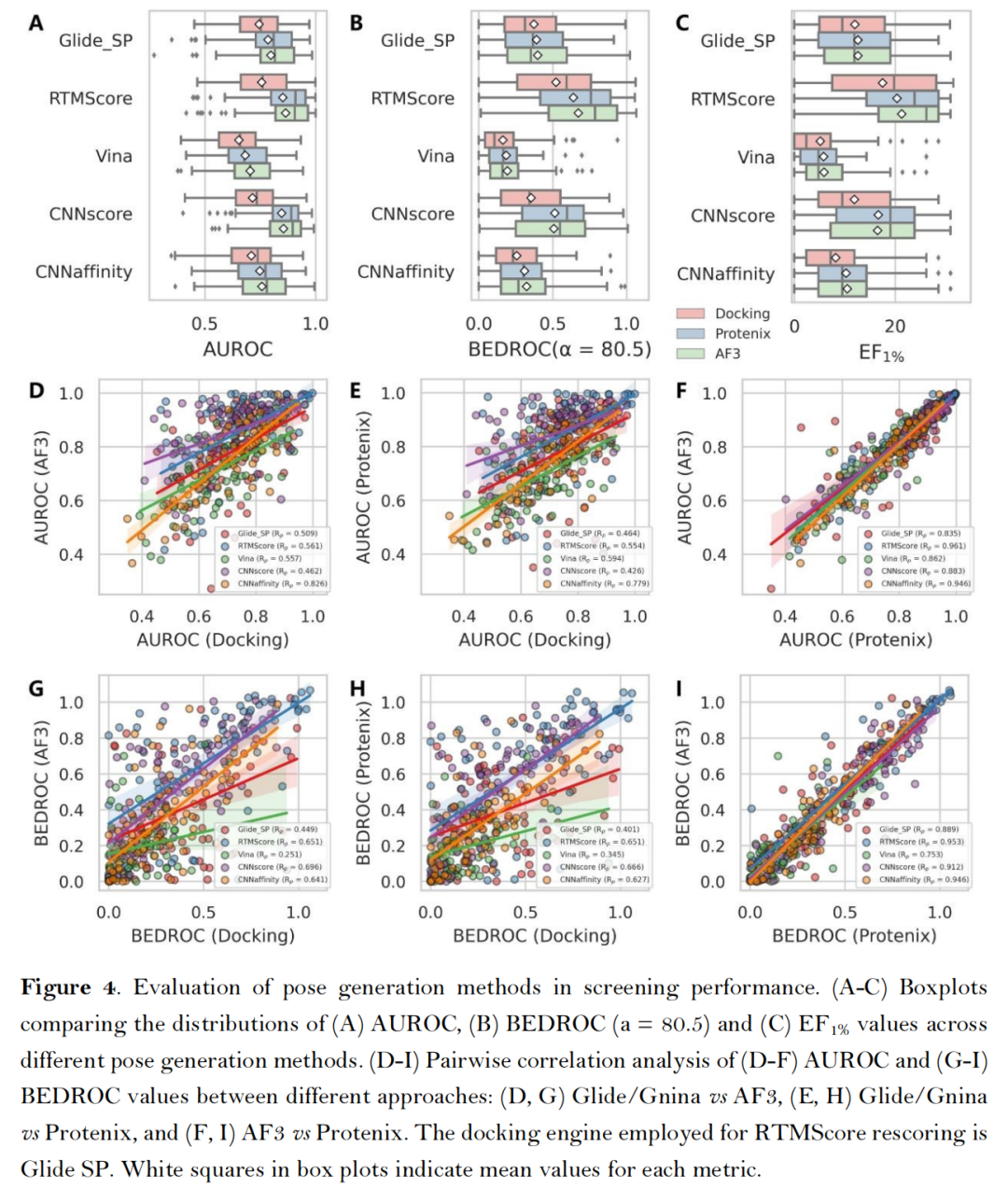
- 互补性与多样性:AF3类方法与传统对接工具筛选出的活性化合物重叠率较低(Top-100重叠率<30%),且能富集结构新颖的候选分子,为多策略联合筛选提供了基础。
4. 模型差异与选型指南
三大模型的性能与特性存在显著差异,为实际应用提供了明确选型依据:
- AF3:筛选性能最优,min-iPAE指标在各类数据集上表现稳定,但计算成本高(内存占用60GB),适合高精度筛选场景;
- Boltz-2:兼顾速度与性能,支持结合亲和力预测,关闭额外模块后计算效率最优,是大规模筛选的优选;
- Protenix:开源免费,构象生成能力可靠,但内置置信度指标优化不足,需搭配CNNscore等外部工具使用以提升性能。
三、药物研发中的实践价值:技术转化与应用路径
1. 虚拟筛选 workflow 优化
基于研究结果,可构建高效的AF3类方法应用流程:
- 优先采用AF3(min-iPAE)或Boltz-2(min-iPAE)作为核心筛选工具,无需依赖外部打分函数;
- 对新靶点或结构新颖配体库,可联合AF3类方法与传统对接工具(如Glide SP),利用两者的互补性提升活性分子检出率;
- 针对大规模化合物库(>10⁶个分子),可采用“初筛-精筛”二级策略:先用Boltz-2(快速模式)初筛,再用AF3进行高精度验证。
2. 关键技术细节与注意事项
- 指标选择:优先使用min-iPAE与ipTM,避免使用pTM进行配体排序;
- 构象处理:对Top-100命中分子进行结构校验,剔除存在严重构象异常的化合物,或通过Protein Preparation Wizard进行手动修正;
- 硬件适配:小规模筛选(<10⁴个分子)可使用AF3,大规模筛选建议选用Boltz-2或Protenix,降低硬件门槛。
四、未来方向与技术展望
1. 现有局限性与优化空间
研究也明确指出了AF3类方法的当前不足:
- 对配体结构新颖性仍有依赖,当配体骨架与训练集差异过大时性能下降;
- 计算成本高于传统对接工具,大规模筛选仍受硬件资源限制;
- 部分罕见官能团(如金刚烷、三氟甲基)的构象预测准确性有待提升。
2. 技术发展趋势
基于研究发现,未来AF3类方法的优化将聚焦三大方向:
- 模型训练优化:扩大多样化配体-蛋白质复合物训练数据,降低对已知结构的依赖;
- 计算效率提升:通过模型压缩、推理加速等技术,适配普通GPU与CPU环境;
- 多任务融合:整合结合亲和力预测、ADMET性质预测等功能,构建一体化药物筛选平台。
3. 临床转化前景
AF3类方法已展现出明确的临床转化潜力:
- 在GPCR、激酶等药物靶点家族中,可快速富集高活性候选分子,缩短早期药物发现周期;
- 对结构解析困难的膜蛋白、蛋白复合物靶点,提供了全新的筛选技术路径;
- 结合实验验证,有望加速罕见病药物、抗感染药物等领域的研发进程。
总结
浙江大学团队的这项研究系统性揭示了AF3类方法在虚拟筛选中的核心价值,通过多数据集、多场景的严格验证,证实了该类方法在筛选性能、结构可靠性与泛化能力上的优势,同时明确了其适用边界与优化方向。AF3类方法通过“结构预测-质量评估”的一体化逻辑,打破了传统虚拟筛选的技术瓶颈,为药物研发提供了更高效、更精准的计算工具。
参考文献: Chao Shen, et al. Unlocking the application potential of AlphaFold3-like approaches in virtual screening, Chem. Sci., 2026
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2025-12-19,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读
目录

