Sci. Adv. | AI 辅助设计细胞内抗体,靶向多肽与组蛋白修饰
Sci. Adv. | AI 辅助设计细胞内抗体,靶向多肽与组蛋白修饰

DrugAI
发布于 2026-01-06 14:29:41
发布于 2026-01-06 14:29:41
DRUGONE
细胞内抗体(intrabody)能够在活细胞内结合特定靶标,在成像、诊断和功能调控中具有独特优势。然而,由于抗体天然进化于胞外环境,其在还原性的胞内条件下往往出现折叠不良、聚集和不稳定等问题,使得从现有抗体序列高效获得功能性 intrabody 一直极具挑战。研究人员提出了一条 AI 辅助的蛋白设计流程,在保留抗原结合互补决定区(CDRs)的前提下,系统性优化抗体框架区。该流程整合了结构预测、序列设计与活细胞筛选,可将大量现有抗体序列快速转化为功能性单链可变片段(scFv)型 intrabody。研究人员成功将 26 条抗体序列中的 19 条转化为可在活细胞中发挥功能的 intrabody,其中包括一整套靶向多种组蛋白修饰的探针,显著拓展了 intrabody 的可用性与应用范围。

Intrabody 是一类能够在细胞内折叠并发挥功能的抗体工程化形式,可用于靶向细胞内蛋白、肽段及翻译后修饰。相比传统基因融合标记,intrbody 在成像瞬时结构、动态修饰以及难以标签的分子方面具有明显优势。然而,绝大多数抗体源自胞外环境,其结构稳定性依赖二硫键,在胞内还原环境中常发生失活。尽管抗体数据库中积累了大量已测序的抗体序列,但其中只有极少数能够直接转化为可用的 intrabody。尤其是在组蛋白修饰研究领域,由于这些修饰是动态可逆的,缺乏合适的活细胞探针严重限制了对染色质调控机制的理解。近年来,蛋白结构预测与生成式设计的 AI 工具快速发展,为系统性改造抗体框架区、提升其胞内可用性提供了新的可能。
方法
研究人员构建了一条 AI 驱动的 intrabody 设计流程。首先,对输入的抗体重链和轻链序列进行注释,精确区分 CDR 与框架区;随后预测抗体–抗原复合物的三维结构;在此基础上,固定 CDR 及其邻近关键残基,仅对框架区进行序列重设计,以提高整体可溶性与稳定性;最后,通过结构评分筛选候选设计,并在活细胞中进行功能验证。该流程既可在已知表位信息存在时使用,也可在缺乏靶标结构信息的情况下运行,显著降低了 intrabody 设计的门槛。
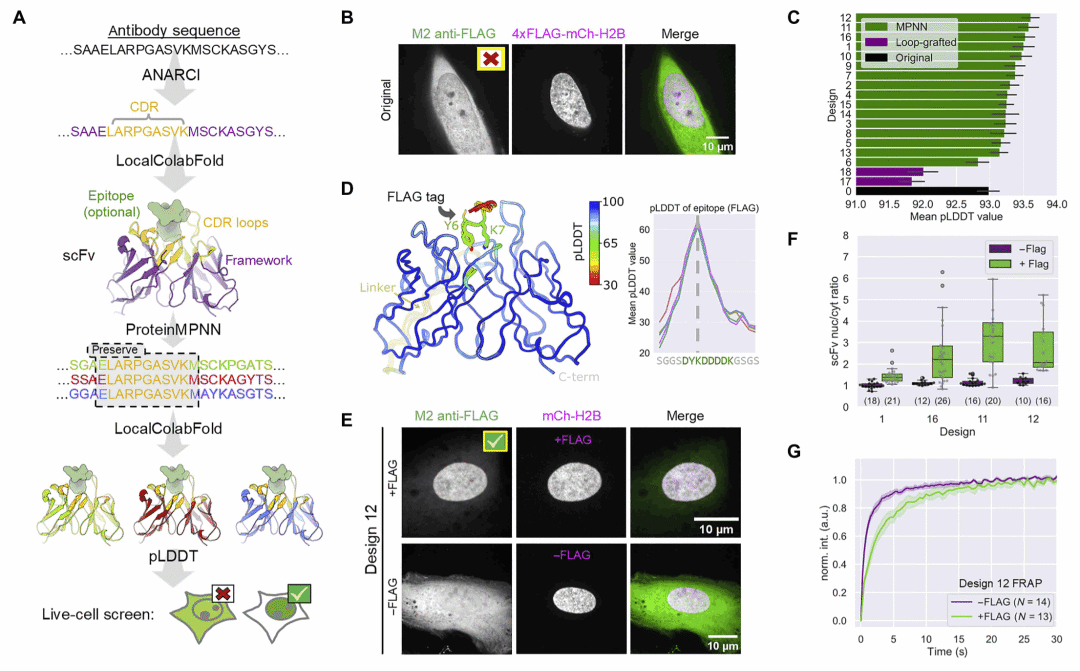
图1 | AI 辅助 intrabody 设计流程示意图,从抗体序列到活细胞验证。
结果
抗体序列向功能性 intrabody 的高效转化
以常用的抗 FLAG 抗体为例,直接转换或传统框架嫁接方法均未获得功能性 intrabody。相比之下,经 AI 流程优化后的多个设计在活细胞中成功定位至靶标位置,并显示出特异结合行为,验证了该策略在改善胞内折叠与功能方面的有效性。
SARS-CoV-2 核衣壳蛋白表位的 intrabody 构建
研究人员进一步将该流程应用于靶向 SARS-CoV-2 核衣壳蛋白线性表位的抗体序列。多个经优化的 scFv 在活细胞中成功结合其靶标,而原始序列则完全失效,表明该方法可推广至缺乏已知结构信息的医学相关抗原。
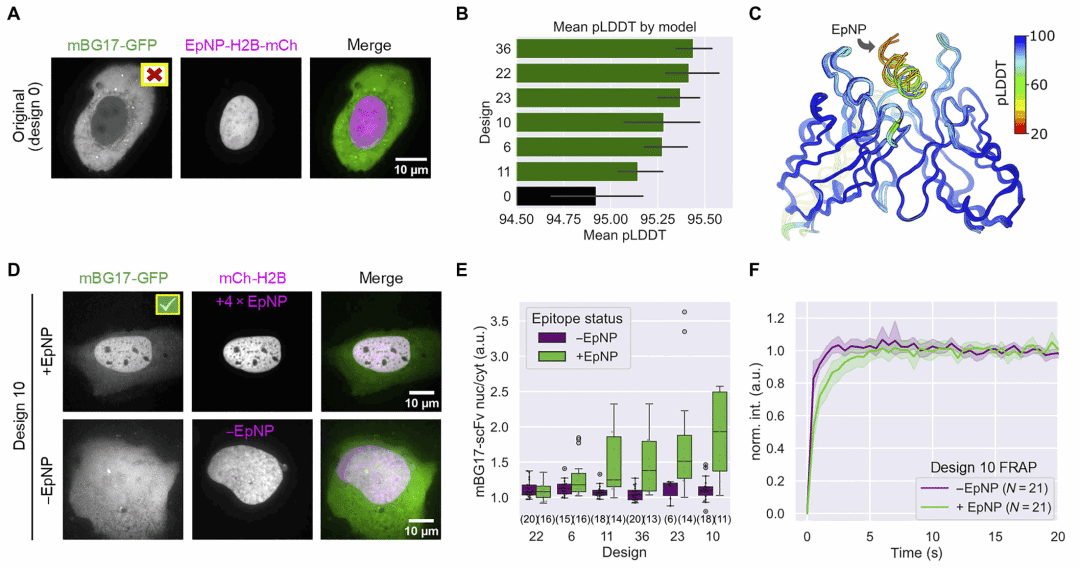
图2 | 靶向 SARS-CoV-2 核衣壳蛋白表位的 intrabody 设计与活细胞验证结果。
靶向组蛋白翻译后修饰的 intrabody
研究人员系统性地将该流程应用于多种已知靶向组蛋白修饰的抗体,包括乙酰化、甲基化和磷酸化位点。结果显示,大多数原本在胞内失效的抗体序列,经优化后可转化为能够在细胞核或有丝分裂染色体上特异定位的 mintbody,从而显著扩大了可用于活细胞成像的组蛋白修饰探针库。
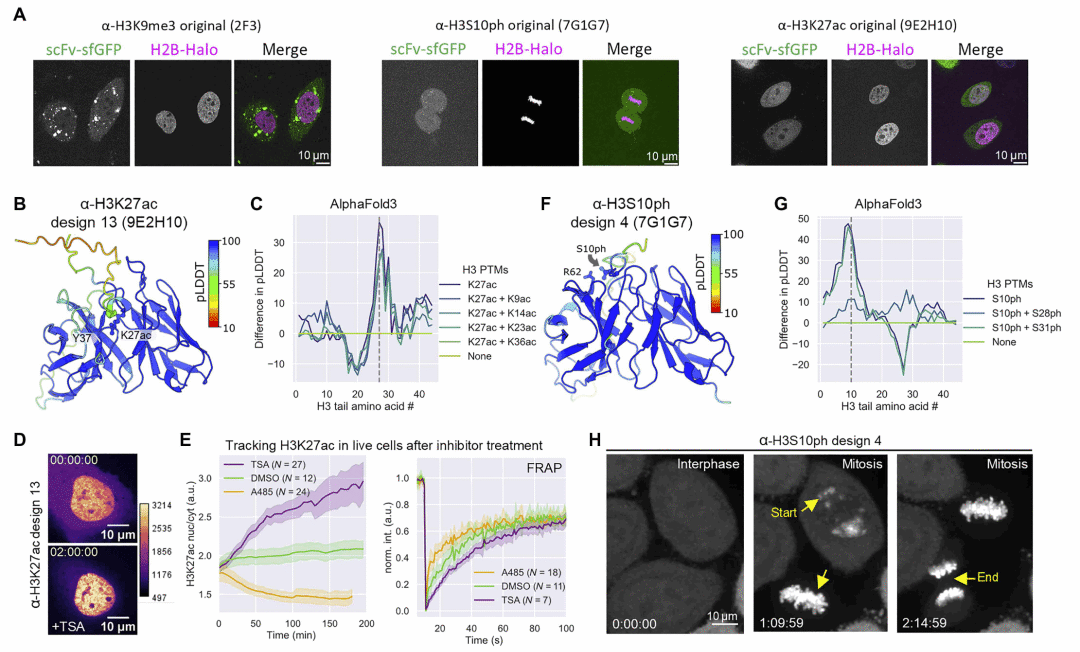
图3 | 针对不同组蛋白修饰的 intrabody 在活细胞中的定位表现。
稳定性、可溶性与特异性验证
与原始序列相比,AI 设计的 intrabody 在还原条件下表现出更高的可溶性与热稳定性,并以单体形式存在。体外与细胞实验均表明,这些 intrabody 保留了与原始抗体相当的修饰特异性和功能响应能力。

图4 | 设计前后 intrabody 在稳定性、可溶性及结合特异性方面的对比。
成功与失败设计的突变模式分析
通过比较大量成功与失败的设计,研究人员发现 intrabody 功能并非由单一关键突变决定,而是依赖于多位点协同变化。结构置信度和溶解性相关指标在一定程度上有助于预测成功率,但仍不足以单独作为判据,凸显了实验验证的重要性。
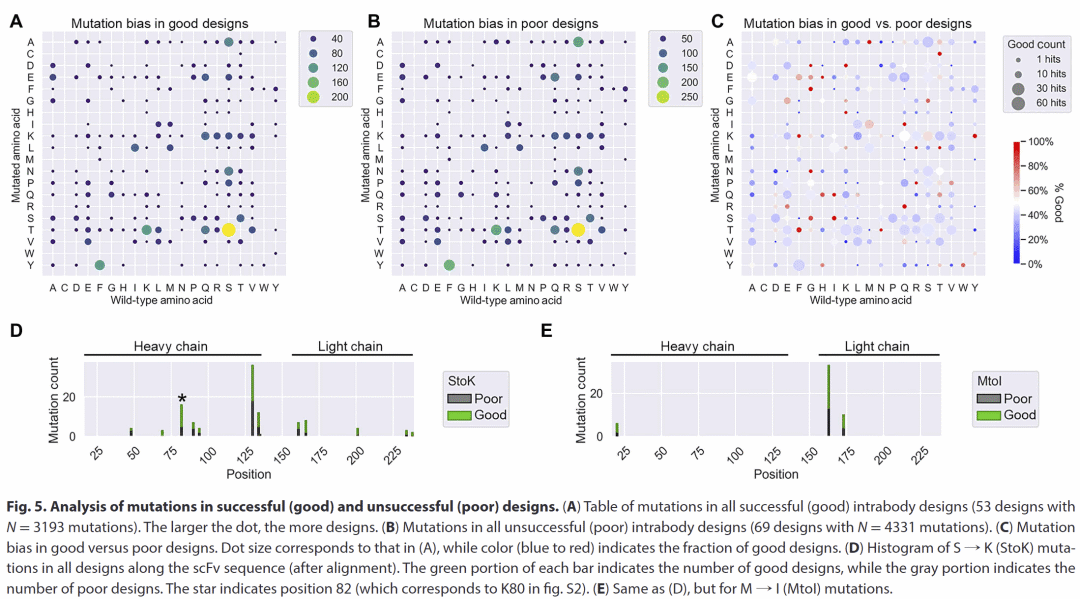
图5 | 成功与失败 intrabody 设计中突变分布与特征分析。
讨论
本研究表明,通过 AI 辅助的系统性框架区优化,可将大量现有抗体序列高效转化为功能性 intrabody,显著突破了传统方法成功率低、依赖经验筛选的限制。该策略尤其适用于组蛋白修饰等动态且难以标记的靶点,为研究染色质结构与基因调控提供了强有力的工具。随着抗体序列数据库的持续扩展,这一流程有望进一步规模化应用,并为下一代专门针对胞内抗体功能优化的设计模型奠定基础。
整理 | DrugOne团队
参考资料
Gabriel Galindo et al. ,AI-assisted protein design to rapidly convert antibody sequences to intrabodies targeting diverse peptides and histone modifications.Sci. Adv.12,eadx8352(2026).
DOI:10.1126/sciadv.adx8352
内容为【DrugOne】公众号原创|转载请注明来源
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2026-01-04,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读

