基于机器学习的药物-受体非键相互作用通用模型:靶标偏好图谱的构建
基于机器学习的药物-受体非键相互作用通用模型:靶标偏好图谱的构建
用户1151118
发布于 2026-01-08 13:07:30
发布于 2026-01-08 13:07:30
A universal model for drug-receptor interactions
期刊: bioRxiv 链接: https://doi.org/10.1101/2025.08.01.668090 简介: 该论文提出了一种基于机器学习的通用模型,可学习和推断药物-受体非键相互作用原理,突破了传统药物设计的局限,创新点在于通过抽象化学身份、学习空间相互作用场来建模物理约束。其方法采用还原论训练策略,不学习药物整体化学结构,而是聚焦药物原子电子类型及其在受体结合口袋中的微环境,利用 20,000 个蛋白质-配体复合物生成 110 多万个训练点训练模型,生成靶标偏好图谱(TPMs)。实验验证显示,模型对多种原子类型预测准确率高,能捕捉化学原理,在金属酶、蛋白相互作用等体系中表现出普适性,前瞻性实验中使抑制剂活性提升近 10 倍。该论文为药物发现提供了理论框架和实用工具,推动结构导向药物设计发展。
在药物发现领域,尽管基因组学与结构生物学已揭示了疾病相关的分子基础,但从分子结构到临床药物的转化仍面临巨大挑战。发表于bioRxiv预印本平台的研究《A universal model for drug-receptor interactions》提出了一种革命性的机器学习模型,通过抽象药物-受体非键相互作用的化学本质,实现了对全新化学实体的精准预测,为结构导向药物设计提供了全新范式。
研究背景:传统药物设计的核心困境
自20世纪70年代以来,基于蛋白质三维结构的“锁钥模型”一直是药物设计的主导思路,但这一框架始终未能实现预期的突破。核心问题在于:药物与受体的相互作用涉及动态复杂的非键相互作用(如氢键、范德华力、π-堆积等),而现有物理模型难以精准捕捉这些作用的本质;同时,实验数据仅覆盖了化学组合空间的极小部分(据估计,类药分子空间约含10⁶⁰个实体,而已发表的蛋白质-配体复合物仅约5万个),且受限于历史合成偏好,导致新药发现陷入“专利拥挤”的传统化学空间。
现有机器学习模型虽试图通过数据驱动方法解决这一问题,但因过度依赖整体分子结构的学习,在面对结构多样的复合物时易出现“记忆偏差”,预测能力急剧下降。制药行业依赖的“设计-合成-测试-分析”(DMTA)循环不仅成本高昂、效率低下,还难以突破传统化学空间的局限。
模型设计:从“分子整体”到“微环境”的范式转换
为突破上述局限,研究团队提出了一种“还原论”的模型设计思路:不直接学习药物分子的整体化学结构,而是聚焦于药物分子中原子的电子类型及其在受体结合口袋中的局部微环境。
模型的训练数据来源于20,000个蛋白质-配体复合物,通过解析每个复合物中原子的类型(如碳的sp³杂化、芳香氮、sp²氧等)、成键特性(如双键、芳香性)及其周围受体氨基酸的空间排布,最终生成超过110万个训练点。这种设计的核心优势在于:
- • 避免对药物化学结构的“记忆”,减少历史合成偏好带来的偏差;
- • 聚焦非键相互作用的物理本质,使模型能够学习到通用的化学作用规律;
- • 大幅扩展有效训练数据量,解决数据稀疏性问题。
模型采用Transformer架构,通过局部坐标系的构建实现旋转不变性,输入为结合口袋中25个最近邻蛋白质原子的空间位置与类型嵌入,输出为该位置不同原子类型的占据概率。
核心创新:靶标偏好图谱(TPMs)的构建与验证
模型训练完成后,能够为任意受体结合口袋中的每个空间点生成“最优原子类型”的概率分布,即靶标偏好图谱(TPMs)。TPMs将受体结构直接转化为对药物化学特征的偏好,覆盖整个结合口袋的三维空间,为药物设计提供了直观且定量的指导。模型性能的关键验证如下:
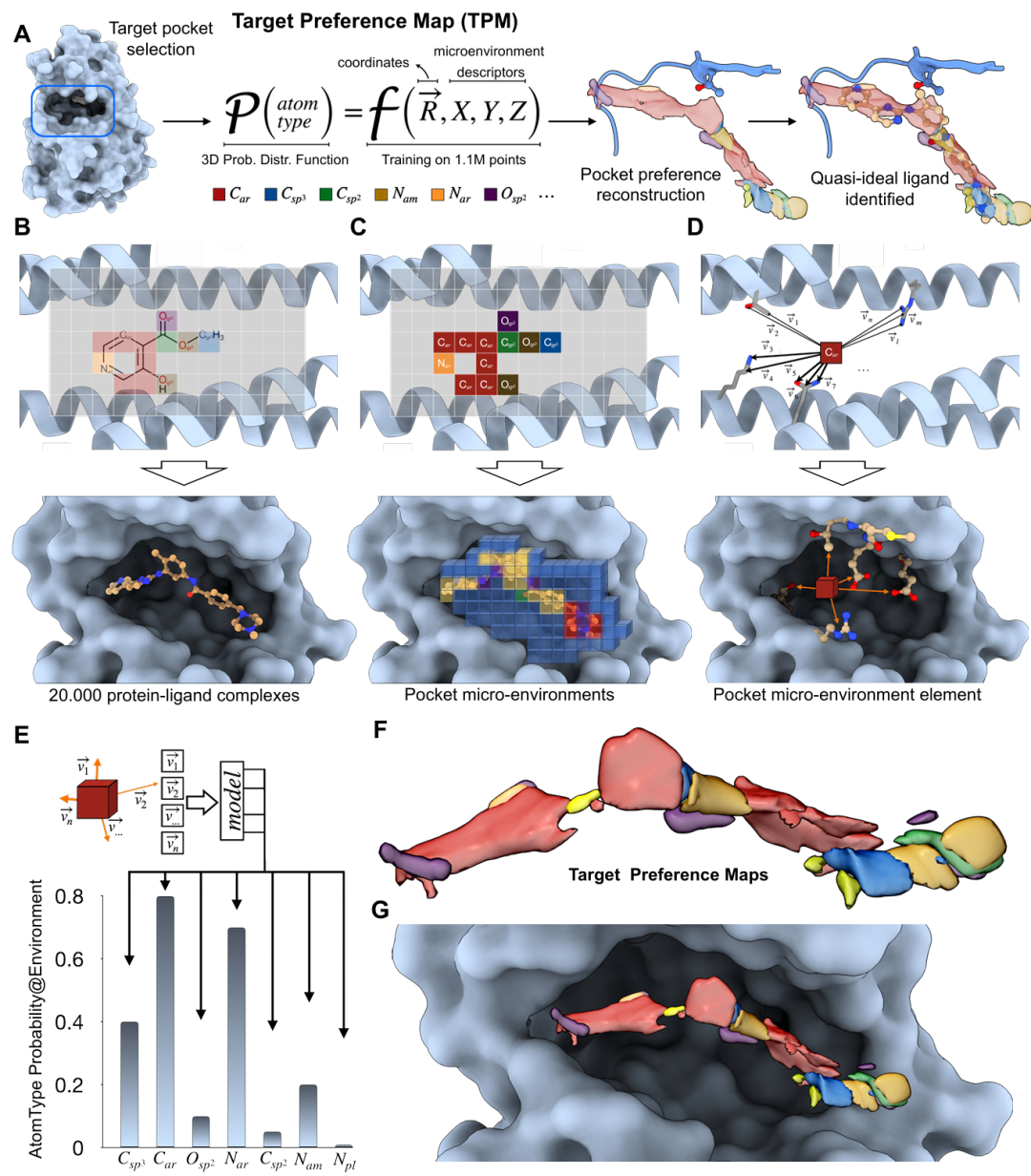
该图展示了 TPM 模型的构建原理与流程。A 为模型概念图,基于生物靶标的结合口袋,定义原子类型特异性的概率分布函数,输入为笛卡尔坐标和三维化学微环境,输出特定原子类型的占据可能性;B-D 为模型构建的二维和三维表示,包括结合口袋体素化、原子类型识别及微环境特征提取(通过收集附近蛋白质原子的邻居向量);E-F 显示模型通过 Transformer/Perceiver 架构学习化学物质分布函数,组装成三维的 TPM;G 为靶标特异性的局部偏好函数。整体呈现了从结合口袋微环境到理想配体特征预测的完整过程。
该图展示了 TPM 模型的构建原理与流程。A 为模型概念图,基于生物靶标的结合口袋,定义原子类型特异性的概率分布函数,输入为笛卡尔坐标和三维化学微环境,输出特定原子类型的占据可能性;B-D 为模型构建的二维和三维表示,包括结合口袋体素化、原子类型识别及微环境特征提取(通过收集附近蛋白质原子的邻居向量);E-F 显示模型通过 Transformer/Perceiver 架构学习化学物质分布函数,组装成三维的 TPM;G 为靶标特异性的局部偏好函数。整体呈现了从结合口袋微环境到理想配体特征预测的完整过程。
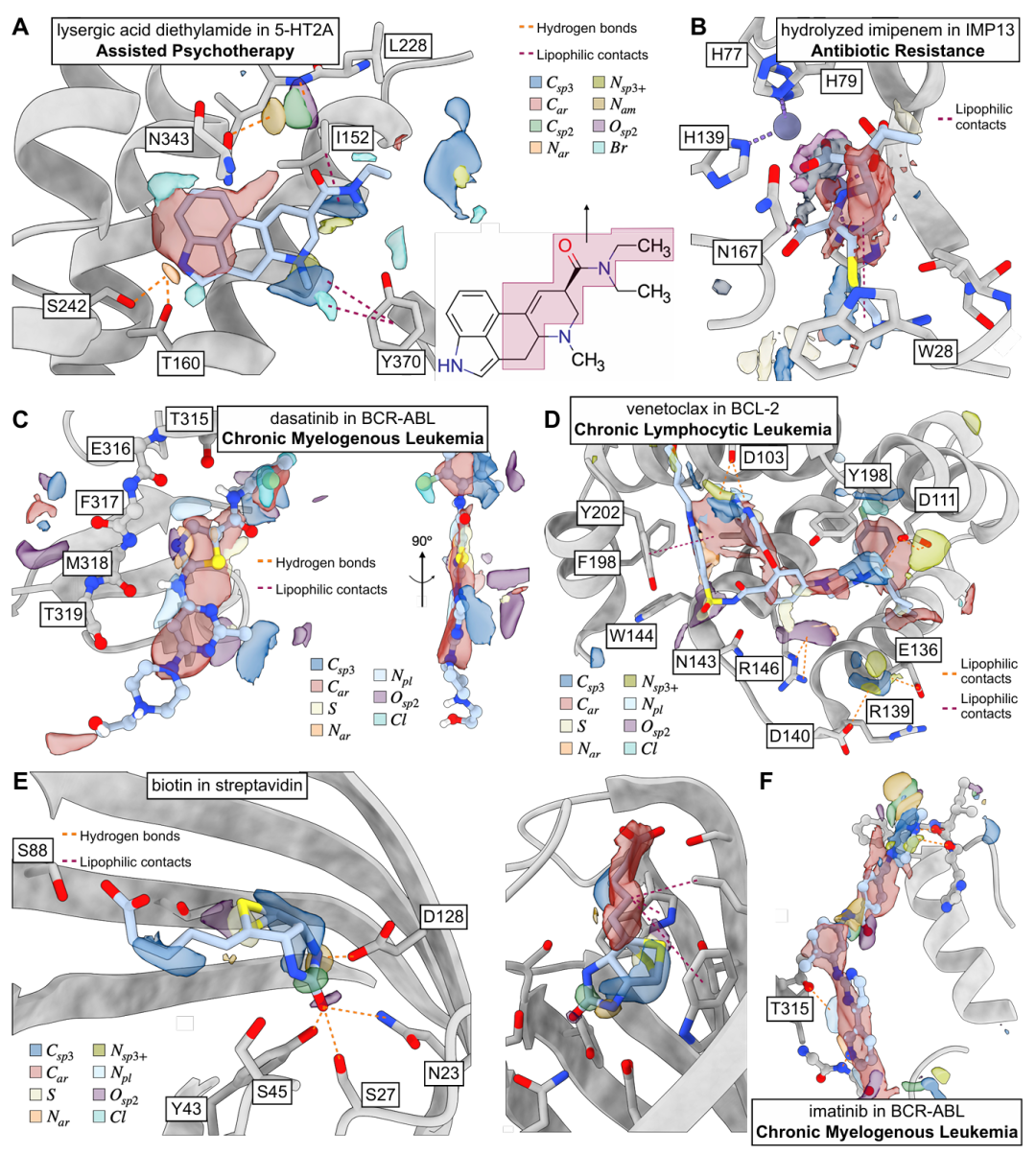
该图展示了 TPM 在多种受体 - 配体复合物中的预测效果。A 为麦角酸二乙酰胺与 5-HT2A 受体结合,TPM 的芳香云与配体芳香基团重叠,准确反映不参与相互作用的酰胺基团;B 为水解亚胺培南与 IMP13 结合,模型虽未接触锌原子训练数据,却能预测羧基以配位 Zn²⁺;C 为达沙替尼与 BCR-ABL1 结合,芳香云与配体芳香基团匹配,且识别氢键供体 / 受体;D 为维奈托克与 BCL-2 结合,建议添加铵基与天冬酰胺作用;E 为生物素与链霉亲和素结合,预测的脂肪碳、酰胺基和硫原子与配体吻合;F 为伊马替尼与 BCR-ABL1 结合,准确捕捉配体芳香范围和氢键特征。这些示例验证了模型的通用性。
该图展示了 TPM 在多种受体 - 配体复合物中的预测效果。A 为麦角酸二乙酰胺与 5-HT2A 受体结合,TPM 的芳香云与配体芳香基团重叠,准确反映不参与相互作用的酰胺基团;B 为水解亚胺培南与 IMP13 结合,模型虽未接触锌原子训练数据,却能预测羧基以配位 Zn²⁺;C 为达沙替尼与 BCR-ABL1 结合,芳香云与配体芳香基团匹配,且识别氢键供体 / 受体;D 为维奈托克与 BCL-2 结合,建议添加铵基与天冬酰胺作用;E 为生物素与链霉亲和素结合,预测的脂肪碳、酰胺基和硫原子与配体吻合;F 为伊马替尼与 BCR-ABL1 结合,准确捕捉配体芳香范围和氢键特征。这些示例验证了模型的通用性。
- 1. 化学原理的精准捕捉
模型对30种常见药物原子类型的预测准确率普遍超过70%,其中磷(P)和硼(B)的准确率高达90%以上。更重要的是,模型能识别原子类型间的相关性规律:例如,不饱和碳(Csp²、Csp、Car)之间高度相关,而与饱和碳(Csp³)呈显著抗相关;卤素原子(F、Cl、Br、I)内部呈现梯度相关性(Br与I的互换性最强),且与硫原子(S)存在交叉相关,反映其脂溶性特征。这些结果与经典 medicinal chemistry 原理完全一致,证明模型真正理解了非键相互作用的化学本质。
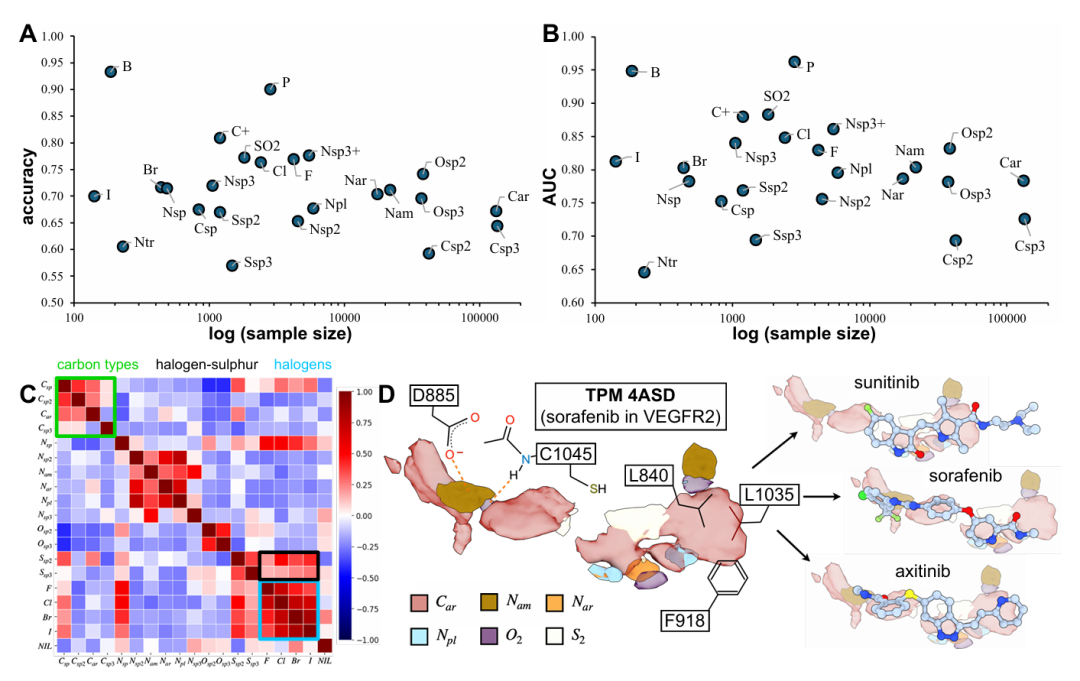
该图呈现模型性能及原子类型相关性分析。A 和 B 分别为各原子类型的准确率和 AUC 值与样本量的关系,显示极性原子类型(如磷、硼)准确率更高(>90%),且性能更多由化学相互作用类型决定而非数据量;C 为原子类型相关矩阵,体现相似性质原子的替换规律(如卤素间高相关、不饱和碳与饱和碳反相关),与传统药物化学替代规则一致;D 为 VEGFR2 与索拉非尼复合物的 TPM 交叉验证,预测与舒尼替尼、阿西替尼的化学组成高度重叠,尤其在芳香密度扩展和硫原子引入上吻合,验证模型的泛化能力。
该图呈现模型性能及原子类型相关性分析。A 和 B 分别为各原子类型的准确率和 AUC 值与样本量的关系,显示极性原子类型(如磷、硼)准确率更高(>90%),且性能更多由化学相互作用类型决定而非数据量;C 为原子类型相关矩阵,体现相似性质原子的替换规律(如卤素间高相关、不饱和碳与饱和碳反相关),与传统药物化学替代规则一致;D 为 VEGFR2 与索拉非尼复合物的 TPM 交叉验证,预测与舒尼替尼、阿西替尼的化学组成高度重叠,尤其在芳香密度扩展和硫原子引入上吻合,验证模型的泛化能力。
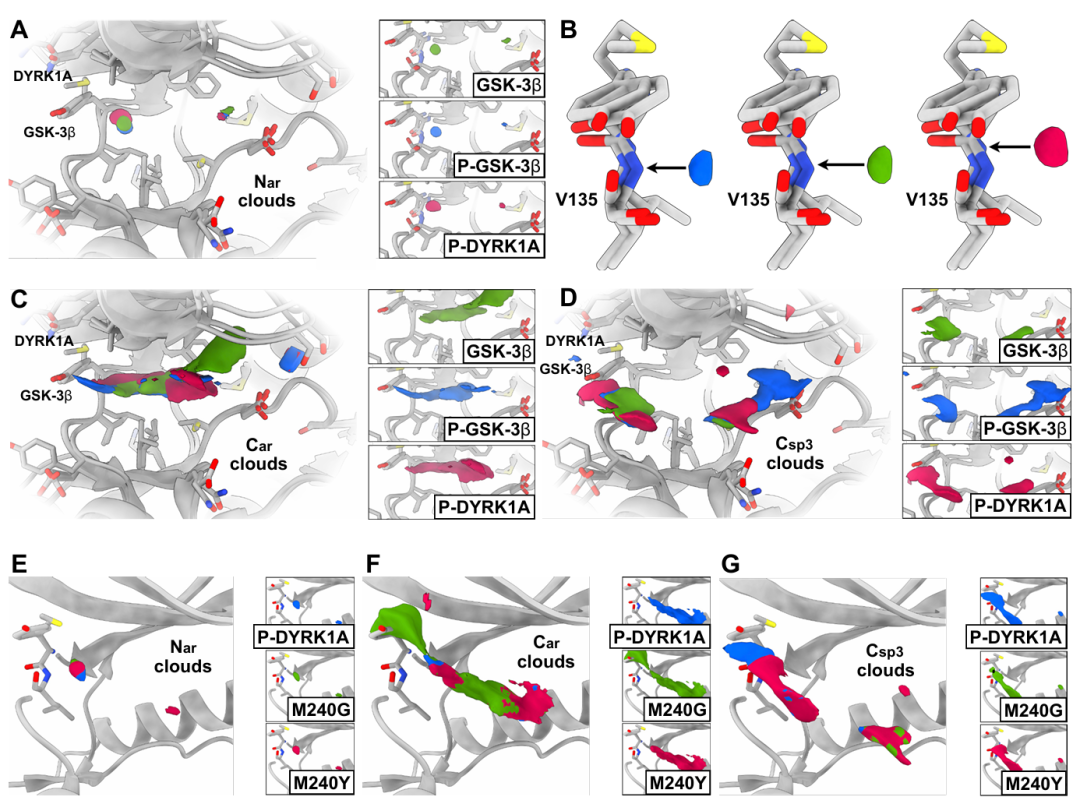
该图以 GSK3β 和 DYRK1A 两种结构相似的激酶为研究对象,展示 TPM 对细微结构差异的敏感性。A 中芳香氮(Nar)的 TPM 信号追踪其结合的铰链残基;C-D 中芳香碳(Car)和 sp³ 碳(Csp³)的 TPM 云形状和范围因系统而异;E-G 显示 DYRK1A 的 Met240 突变为 Gly(开放结合位点)后,Car 云扩展,突变为 Tyr(模拟 GSK3β)后,Car 云收缩,而 Nar 信号保持不变。结果证明 TPM 对结合口袋局部组成高度敏感,而非记忆整体结构。
该图以 GSK3β 和 DYRK1A 两种结构相似的激酶为研究对象,展示 TPM 对细微结构差异的敏感性。A 中芳香氮(Nar)的 TPM 信号追踪其结合的铰链残基;C-D 中芳香碳(Car)和 sp³ 碳(Csp³)的 TPM 云形状和范围因系统而异;E-G 显示 DYRK1A 的 Met240 突变为 Gly(开放结合位点)后,Car 云扩展,突变为 Tyr(模拟 GSK3β)后,Car 云收缩,而 Nar 信号保持不变。结果证明 TPM 对结合口袋局部组成高度敏感,而非记忆整体结构。
- 2. 复杂体系的普适性
在针对含锌金属酶IMP-13(与抗生素耐药相关)的测试中,模型虽未在训练中接触过锌离子,却能准确预测出羧基基团以配位Zn²⁺,且与已知抑制剂的结构高度吻合。此外,模型还能预测出硫原子在锌离子附近的有利位置,符合锌的配位化学特性,展现出对量子化学层面相互作用的捕捉能力。
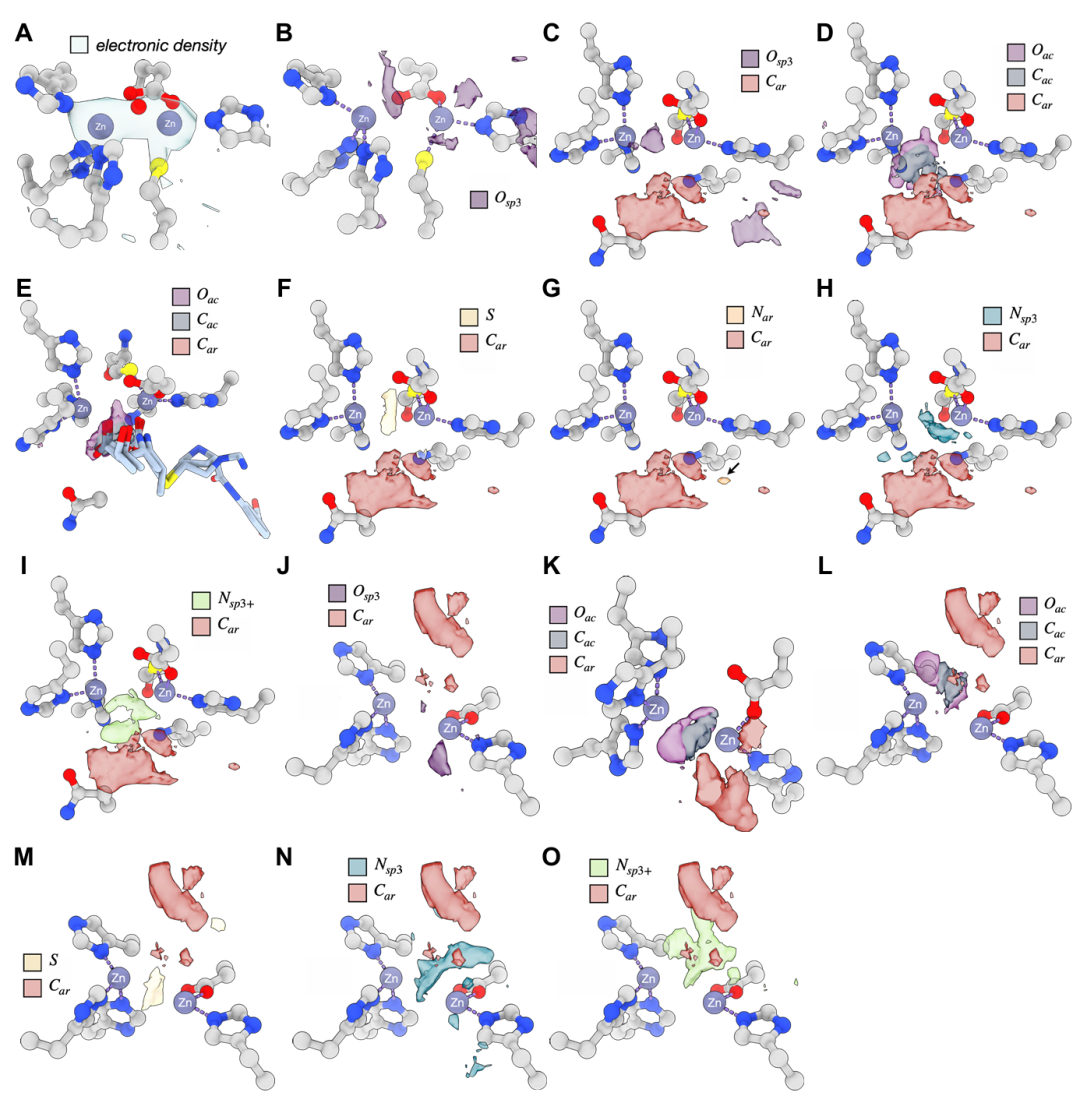
该图展示 TPM 对含锌金属酶 IMP13 的预测结果。A 为 apo-IMP13 的实验电子密度,显示锌离子间的羟基;B-C 中 sp³ 氧信号与锌离子间桥接氧精准重叠;D-E 预测的羧基信号与已知抑制剂的羧基高度吻合;F-G 预测硫原子靠近锌离子(符合锌配位化学),而芳香氮(Nar)无信号;H-I 显示铵基(Nsp³、Nsp³⁺)信号延伸至锌离子附近,虽不直接配位但与金属阳离子有相似路易斯酸性。这些结果在另一种结构模型中得到验证,体现模型对复杂过渡金属化学的捕捉能力。
该图展示 TPM 对含锌金属酶 IMP13 的预测结果。A 为 apo-IMP13 的实验电子密度,显示锌离子间的羟基;B-C 中 sp³ 氧信号与锌离子间桥接氧精准重叠;D-E 预测的羧基信号与已知抑制剂的羧基高度吻合;F-G 预测硫原子靠近锌离子(符合锌配位化学),而芳香氮(Nar)无信号;H-I 显示铵基(Nsp³、Nsp³⁺)信号延伸至锌离子附近,虽不直接配位但与金属阳离子有相似路易斯酸性。这些结果在另一种结构模型中得到验证,体现模型对复杂过渡金属化学的捕捉能力。
- 3. 药物优化的实战价值
在针对PEX14-PEX5蛋白相互作用(寄生虫感染的难靶向靶点)的前瞻性实验中,模型提出的修饰建议使抑制剂活性提升近10倍:通过引入环丙基(匹配Csp³偏好)、调整芳香基团连接位置(优化与Car图谱的重叠)、增加铵基(与Nsp³⁺偏好匹配),最终化合物的抗寄生虫活性()从0.851μM降至0.089μM,选择性指数(SI)从13.4提升至42.1。这一结果验证了TPMs在突破传统优化瓶颈方面的独特价值。
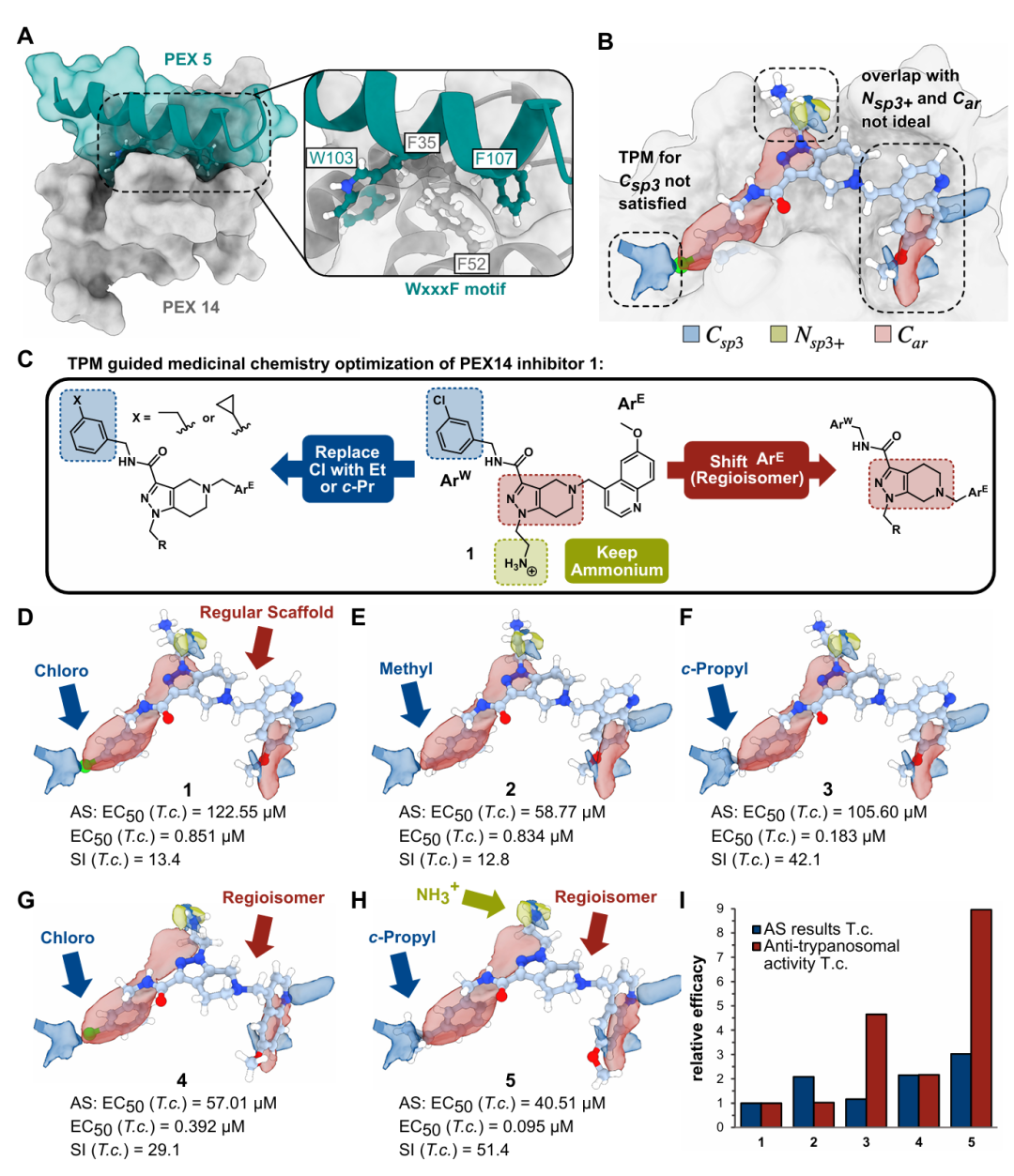
该图展示 TPM 指导难靶向蛋白相互作用抑制剂优化的过程。A 为 PEX14-PEX5 相互作用界面及关键残基;B 基于 5L87 晶体结构的 TPM 预测,提出三项修饰建议:引入烷基(匹配 Csp³ 区域)、调整芳香基团连接位置(优化与 Car 密度重叠)、添加乙基铵基(与 Glu34 和 Asp38 作用);C 为 medicinal chemistry 优化策略;D-I 展示化合物 1-5 的结构、 efficacy 及选择性,其中化合物 5 整合所有修饰,抗寄生虫活性提升近 10 倍,验证 TPM 的实用价值。
该图展示 TPM 指导难靶向蛋白相互作用抑制剂优化的过程。A 为 PEX14-PEX5 相互作用界面及关键残基;B 基于 5L87 晶体结构的 TPM 预测,提出三项修饰建议:引入烷基(匹配 Csp³ 区域)、调整芳香基团连接位置(优化与 Car 密度重叠)、添加乙基铵基(与 Glu34 和 Asp38 作用);C 为 medicinal chemistry 优化策略;D-I 展示化合物 1-5 的结构、 efficacy 及选择性,其中化合物 5 整合所有修饰,抗寄生虫活性提升近 10 倍,验证 TPM 的实用价值。
应用前景与局限性
TPMs的出现为药物研发提供了多维度的应用可能:
- • 指导 medicinal chemists 进行理性分子设计,减少合成盲目性;
- • 作为分子对接或生成模型的输入条件,提升新分子设计的效率;
- • 与分子动力学、量子化学结合,实现多尺度的药物-受体相互作用解析。
但模型仍存在局限性:
- • 基于静态晶体结构训练,未能捕捉受体动态与熵效应;
- • 忽略分子内相互作用(如张力、构象能),可能限制化合物的可合成性评估;
- • 未纳入亲和力数据,难以直接预测绝对结合自由能。
未来通过整合分子动力学轨迹、引入能量建模等方法,有望进一步完善这一框架。
结语
这项研究通过“还原论”思路与机器学习的结合,首次实现了对药物-受体非键相互作用原理的通用建模,其提出的靶标偏好图谱(TPMs)为新药研发提供了从“经验筛选”到“理性设计”的桥梁。对于药物化学、结构生物学及计算生物学领域的研究者而言,这一模型不仅是一种工具,更代表了一种理解分子识别的全新视角——当我们能够精准解读受体对原子微环境的“偏好”时,新药发现的效率与成功率或将迎来质的飞跃。
这篇文章画的图真的好看!🤏
附录
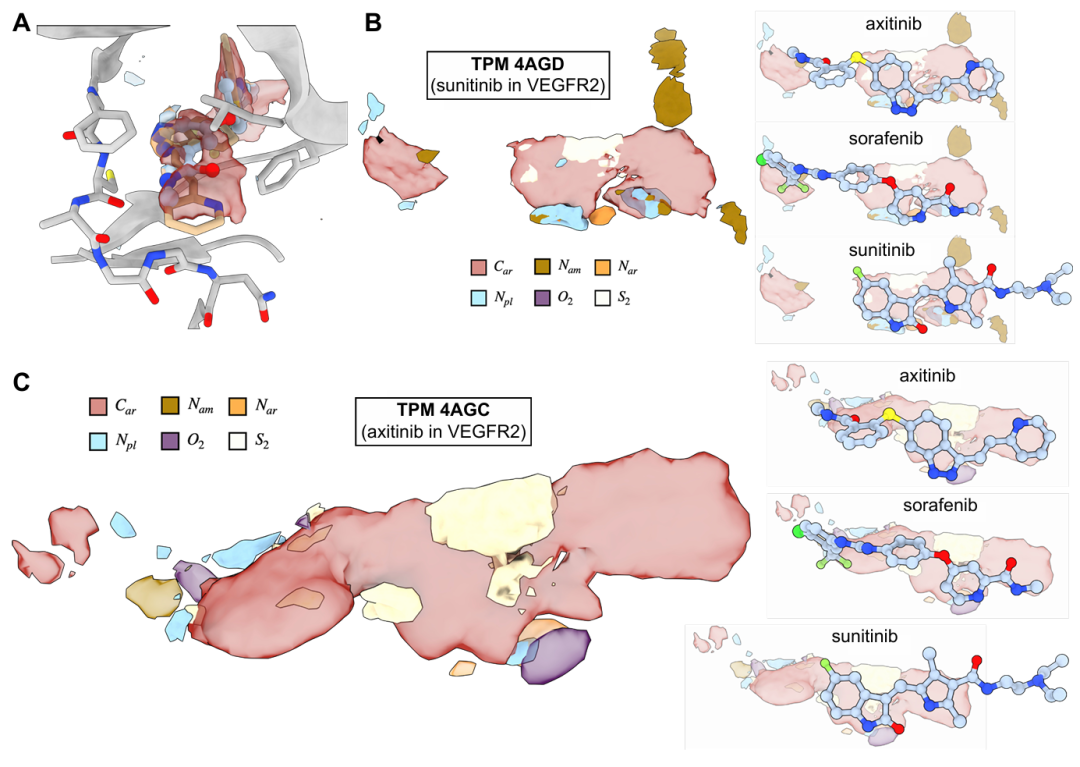
图 S1:VEGFR 晶体结构的 TPM 额外验证。该图补充验证 TPM 在 VEGFR 与索拉非尼、舒尼替尼、阿西替尼复合物中的预测。A 中阿西替尼的吡啶环氮不与靶标作用,TPM 无对应信号;B 为舒尼替尼结合的 VEGFR 的 TPM 与其他配体的重叠;C 为阿西替尼结合的 VEGFR 的 TPM 与其他配体的重叠。结果进一步证明 TPM 不依赖特定配体,而是捕捉受体固有偏好。
图 S1:VEGFR 晶体结构的 TPM 额外验证。该图补充验证 TPM 在 VEGFR 与索拉非尼、舒尼替尼、阿西替尼复合物中的预测。A 中阿西替尼的吡啶环氮不与靶标作用,TPM 无对应信号;B 为舒尼替尼结合的 VEGFR 的 TPM 与其他配体的重叠;C 为阿西替尼结合的 VEGFR 的 TPM 与其他配体的重叠。结果进一步证明 TPM 不依赖特定配体,而是捕捉受体固有偏好。
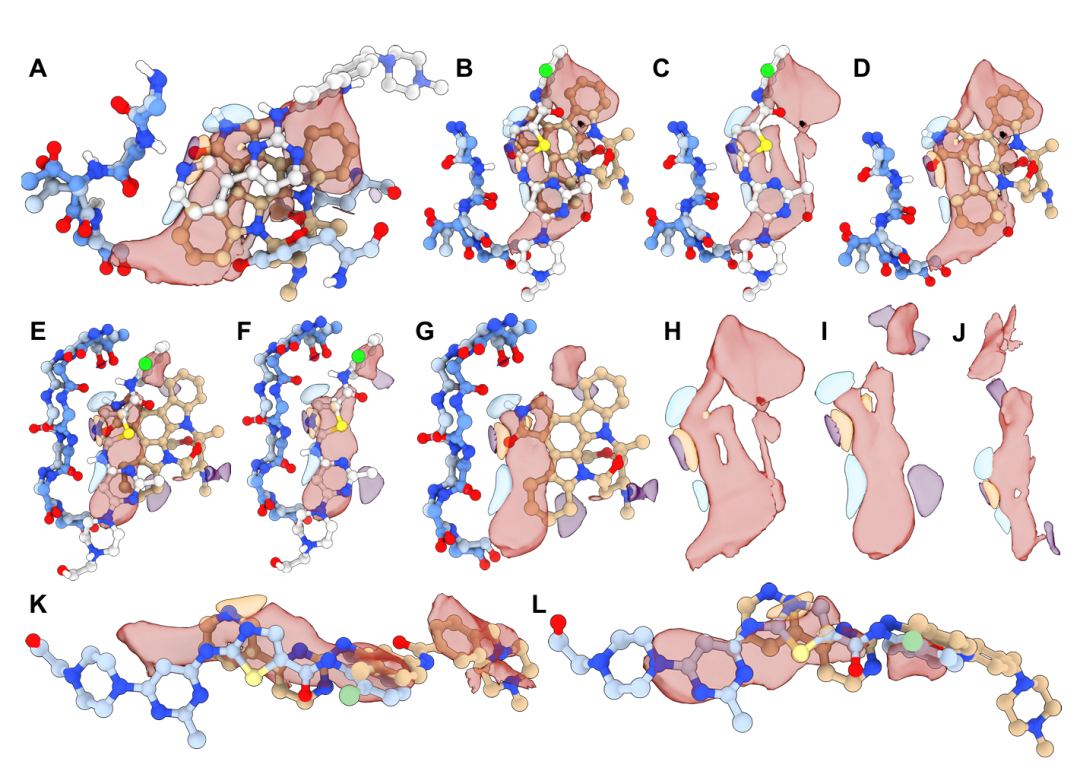
图 S2:实验晶体结构中的配体印记分析。该图分析配体对 TPM 预测的影响。A 为伊马替尼与星孢菌素在 BCR-ABL1 中的结构重叠,TPM 反映各自配体化学特征;B-L 展示不同配体结合的 BCR-ABL1 的 TPM 差异,显示 TPM 受配体影响但能捕捉通用结合特征,证明模型未过度记忆特定配体结构。
图 S2:实验晶体结构中的配体印记分析。该图分析配体对 TPM 预测的影响。A 为伊马替尼与星孢菌素在 BCR-ABL1 中的结构重叠,TPM 反映各自配体化学特征;B-L 展示不同配体结合的 BCR-ABL1 的 TPM 差异,显示 TPM 受配体影响但能捕捉通用结合特征,证明模型未过度记忆特定配体结构。
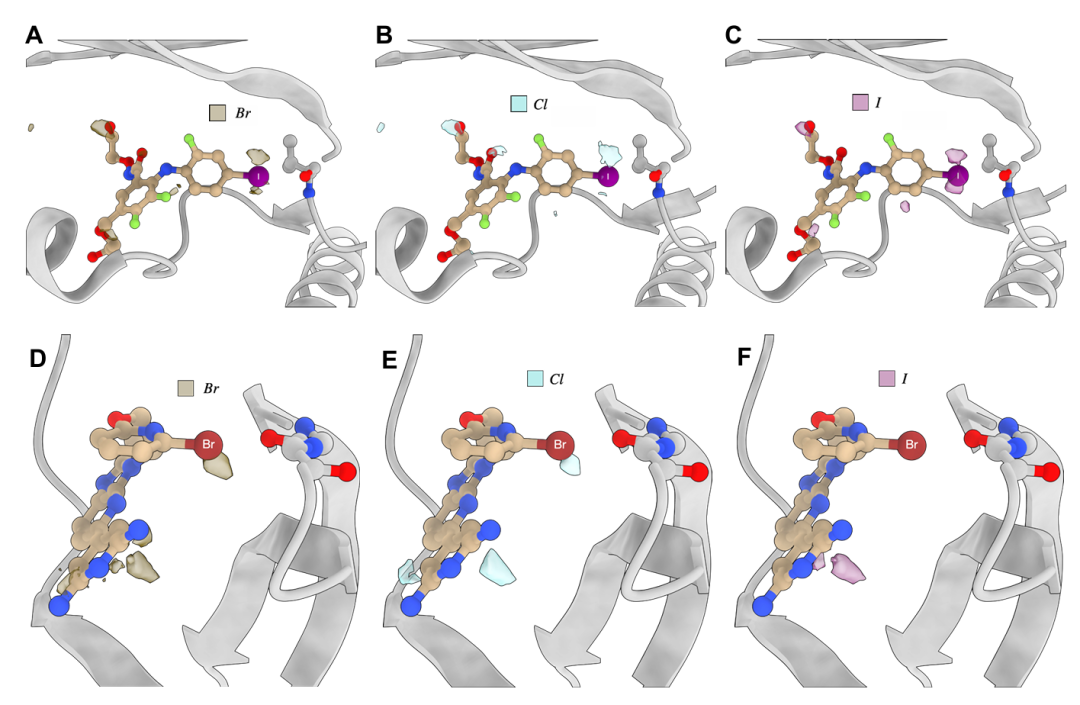
图 S3:TPM 中卤素信号的特异性。该图展示 TPM 对卤素原子的预测特异性。A-C 为 MEK 激酶与含卤素抑制剂结合,溴、氯、碘信号部分重叠但碘有特异性;D-F 为 DYRK1A 与含卤素配体结合,溴与氯信号可互换,碘信号则不同。体现模型对卤素化学性质差异的识别。
图 S3:TPM 中卤素信号的特异性。该图展示 TPM 对卤素原子的预测特异性。A-C 为 MEK 激酶与含卤素抑制剂结合,溴、氯、碘信号部分重叠但碘有特异性;D-F 为 DYRK1A 与含卤素配体结合,溴与氯信号可互换,碘信号则不同。体现模型对卤素化学性质差异的识别。
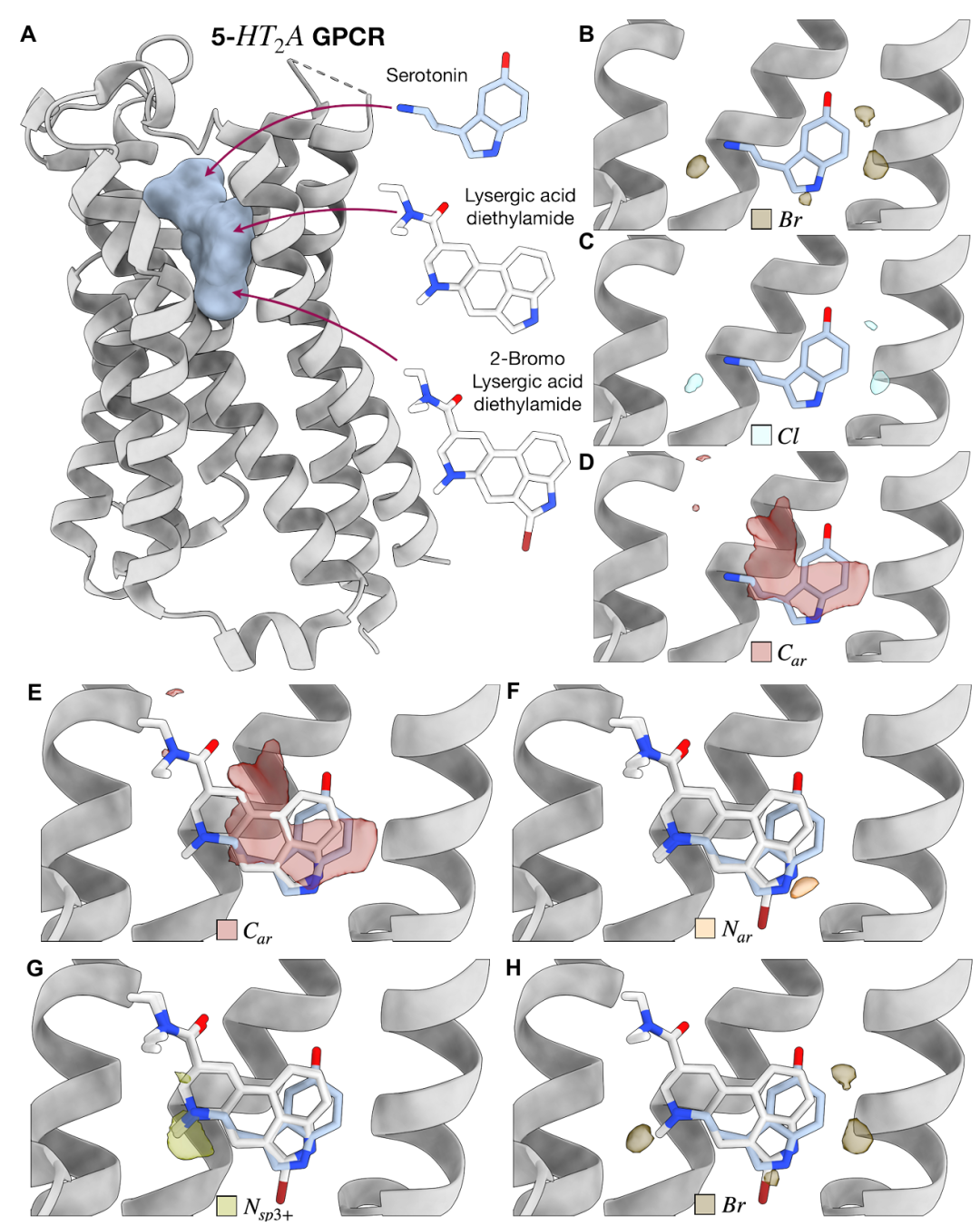
图 S4:5-HT2A GPCR 的 TPM 预测。该图展示 5-HT2A 受体的 TPM 预测。A 为受体与血清素、麦角酸二乙酰胺等配体的结构;B-D 为溴、氯、芳香碳的 TPM 与配体的重叠;E-G 为芳香碳、芳香氮、铵基氮的预测与配体的匹配;H 为溴信号与 2 - 溴麦角酸二乙酰胺的重叠,验证模型对特定卤素修饰的预测能力。
图 S4:5-HT2A GPCR 的 TPM 预测。该图展示 5-HT2A 受体的 TPM 预测。A 为受体与血清素、麦角酸二乙酰胺等配体的结构;B-D 为溴、氯、芳香碳的 TPM 与配体的重叠;E-G 为芳香碳、芳香氮、铵基氮的预测与配体的匹配;H 为溴信号与 2 - 溴麦角酸二乙酰胺的重叠,验证模型对特定卤素修饰的预测能力。
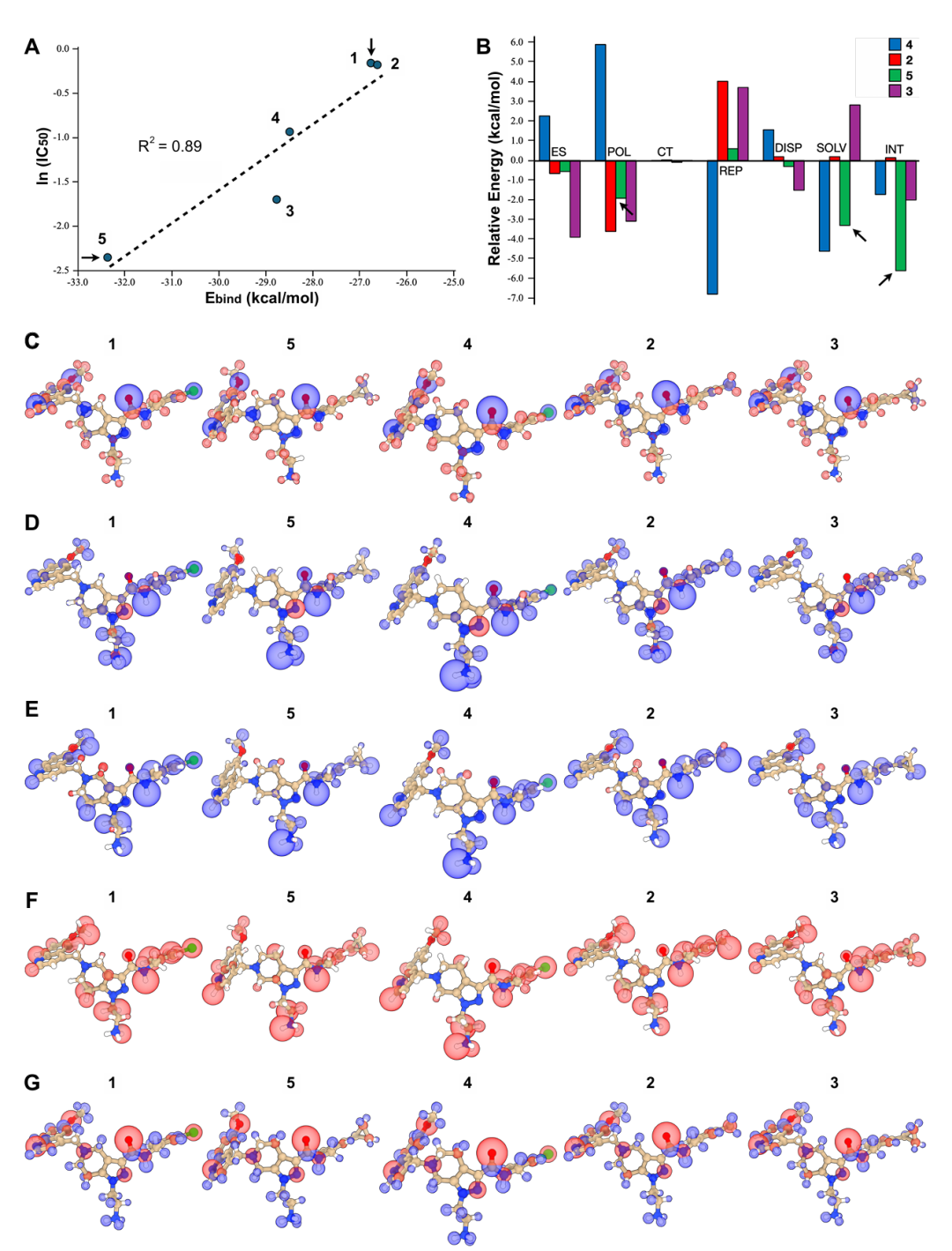
图 S5:TPM 生成配体的量子力学验证。该图通过量子力学计算验证 TPM 优化的配体。A 为实验 IC50 与量子力学结合能的相关性;B 显示化合物 5 的效能提升源于极化和溶剂化效应改善;C-G 为配体的静电图、总相互作用图、极化图、重叠排斥图和溶剂化图,体现细微化学差异对结合的影响,佐证 TPM 预测与物理原理的一致性。
图 S5:TPM 生成配体的量子力学验证。该图通过量子力学计算验证 TPM 优化的配体。A 为实验 IC50 与量子力学结合能的相关性;B 显示化合物 5 的效能提升源于极化和溶剂化效应改善;C-G 为配体的静电图、总相互作用图、极化图、重叠排斥图和溶剂化图,体现细微化学差异对结合的影响,佐证 TPM 预测与物理原理的一致性。
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2025-08-13,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读
目录

