Nat. Mach. Intell. | 图 Transformer 驱动的生成对抗网络实现靶点导向的候选药物分子全新设计
Nat. Mach. Intell. | 图 Transformer 驱动的生成对抗网络实现靶点导向的候选药物分子全新设计
用户1151118
发布于 2026-01-08 14:03:44
发布于 2026-01-08 14:03:44
DRUGONE
发现全新候选药物分子是药物开发的核心步骤。深度生成模型能够从学习到的概率分布中采样新分子结构,但其在药物发现中的实际应用取决于能否生成针对特定靶点的化合物。研究人员提出了 DrugGEN,一种端到端的生成系统,用于设计能与指定蛋白结合的候选药物分子。DrugGEN 以分子图为输入,并通过结合图 Transformer 层的生成对抗网络进行处理。模型在大规模药物样本与靶点特异性活性分子数据上训练,并应用于设计 AKT1 激酶抑制剂。分子对接和分子动力学模拟结果显示,生成的分子能够有效结合 AKT1;注意力机制可视化进一步揭示了模型推理过程。部分分子经合成并在体外实验中验证,对 AKT1 展现出低微摩尔水平的抑制活性,显示出 DrugGEN 在靶点特异性分子设计中的潜力。

药物研发是一个高成本、周期长的过程,初始关键环节是识别针对特定靶点的活性分子。尽管高通量筛选可同时测试数万种化合物,但化学与靶点空间的规模巨大,使得找到最佳候选分子仍极具挑战。许多候选药物在临床阶段因毒性或低效被终止,导致整体成功率较低。
传统小分子药物集中于有限的蛋白家族,结构多样性不足。虚拟化学空间虽庞大(约 10³⁰–10⁶⁰),但其中能与靶点特异性结合的分子难以直接定位。全新设计(de novo design) 旨在生成完全不同于已有分子的候选药物,以突破难以成药的靶点。
近年来,人工智能驱动的生成建模在药物设计中快速发展,涵盖变分自编码器、生成对抗网络、序列模型、几何模型及扩散模型等方法。尽管这些方法能够优化分子性质,但能否真正生成能与靶点结合的分子仍是核心挑战。DrugGEN 的提出正是为解决这一问题。
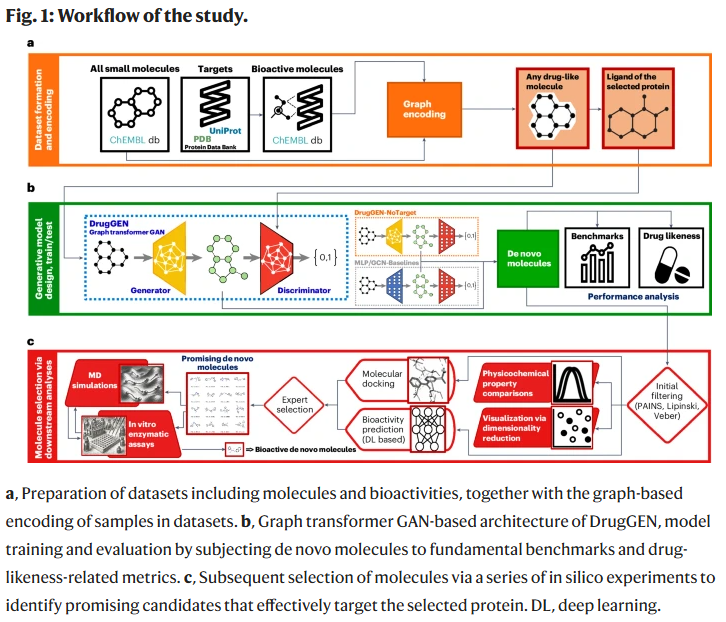
结果
DrugGEN 框架概览
DrugGEN 旨在学习药物与候选分子的理化性质及拓扑特征分布,从而生成既合理又新颖的类药小分子。生成器生成新分子图,判别器则将其与靶点真实配体比较,并在对抗学习中反馈给生成器,从而引导其朝着靶点结合分子方向优化。DrugGEN 在生成器与判别器中均引入图 Transformer,有效捕捉原子与键之间的长程依赖关系。
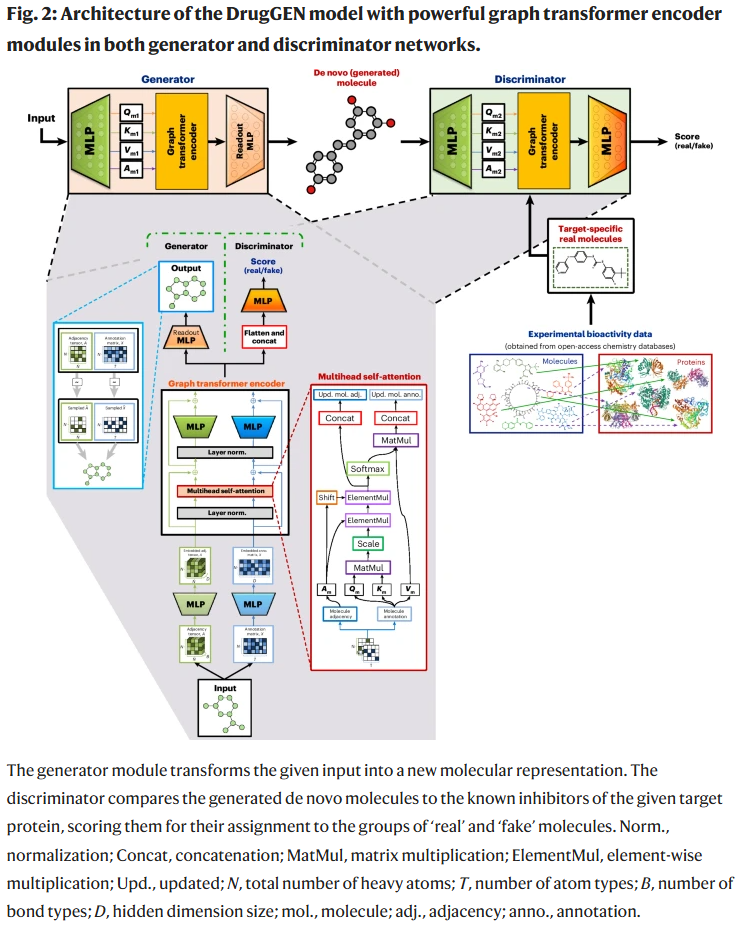
生成性能评估
研究人员在 MOSES 基准和多项生成评价指标(有效性、唯一性、新颖性、多样性、合成可行性、类药性等)上对 DrugGEN 进行了测试。结果表明,DrugGEN 与其非靶点版本(DrugGEN-NoTarget)在多项指标上排名领先,表现优于多种对比模型。
靶点特异性分子设计
DrugGEN 针对 AKT1 和 CDK2 两个靶点进行了训练与测试:
- AKT1:DrugGEN 生成的分子在分子对接中获得 −8.386 kcal/mol 的结合能,几乎接近真实抑制剂水平,优于 RELATION、TargetDiff、Pocket2Mol 等模型。
- CDK2:DrugGEN 的结合能位于前 10%,同时展现出良好的类药性(QED 值 0.547),在 Lipinski、Veber 与 PAINS 等规则下均表现优良。
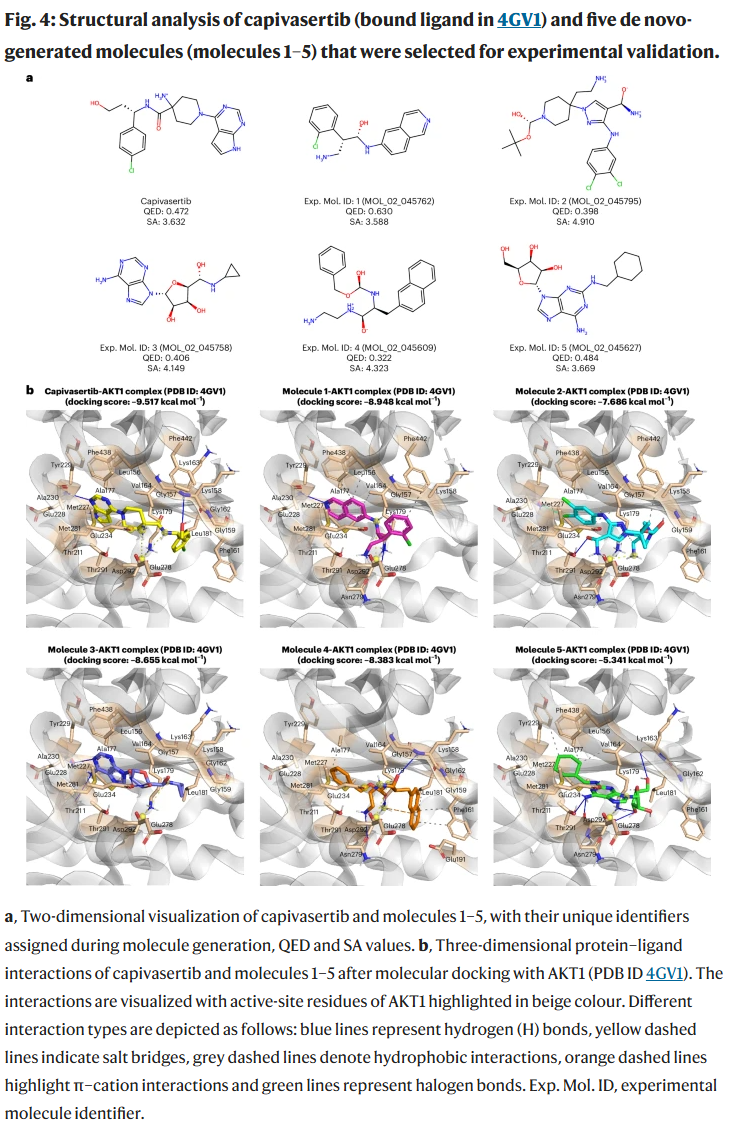
此外,DrugGEN 生成了 40 个结合力超过临床候选药物 capivasertib 的分子。
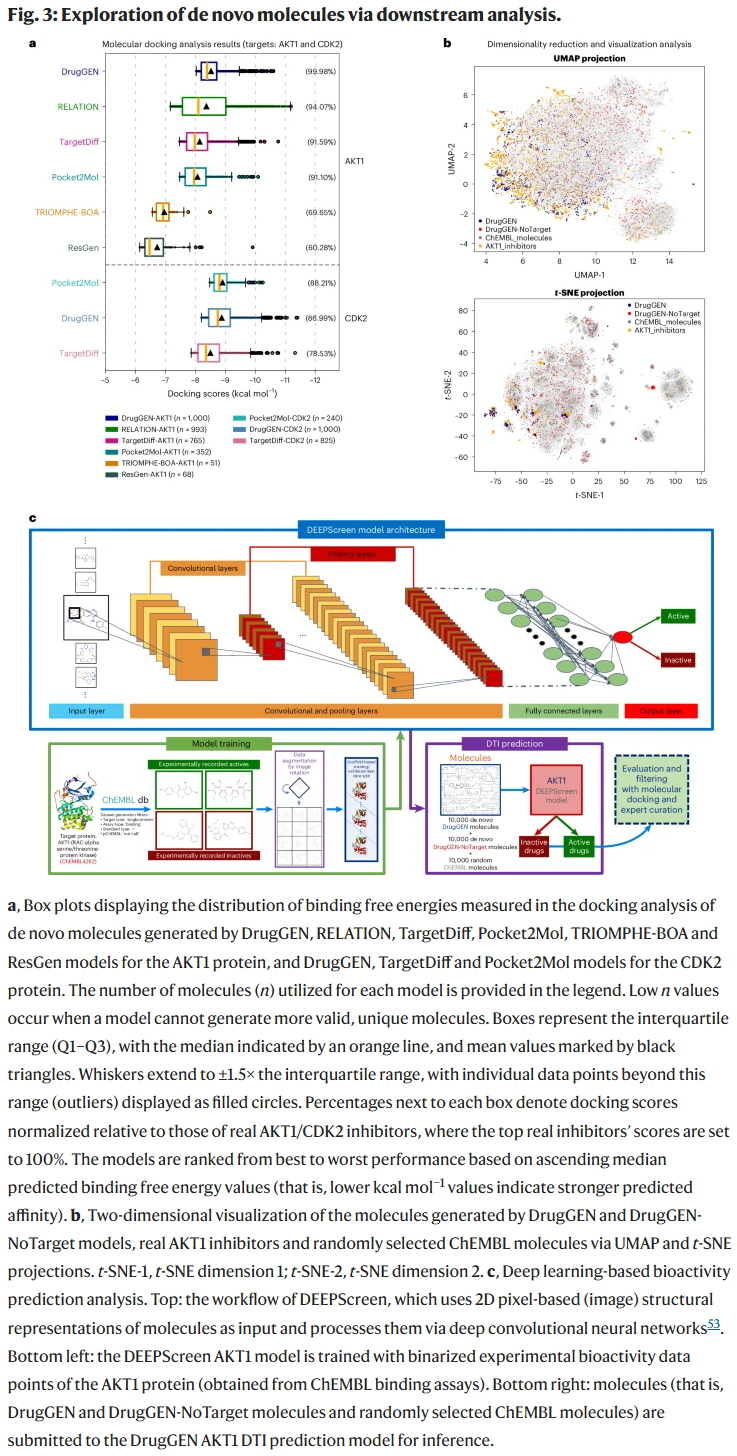
实验验证
研究人员人工筛选出 30 个潜在分子,其中 5 个被合成并进行体外酶学实验。结果表明:
- 分子 1 的 IC50 为 1.89 μM;
- 分子 2 的 IC50 为 48.6 μM;
- 其他 3 个分子活性不足。
分子动力学模拟进一步揭示了分子 1 与关键残基 Ala230、Tyr229 等的稳定结合模式。
分子特征与解释性分析
UMAP 与 t-SNE 可视化显示,DrugGEN 生成的分子在结构上与真实 AKT1 抑制剂聚类相似,而 DrugGEN-NoTarget 的分布较为分散。注意力可视化分析表明,模型能够准确识别 91% 与 AKT1 形成关键相互作用的原子,体现出较强的可解释性。
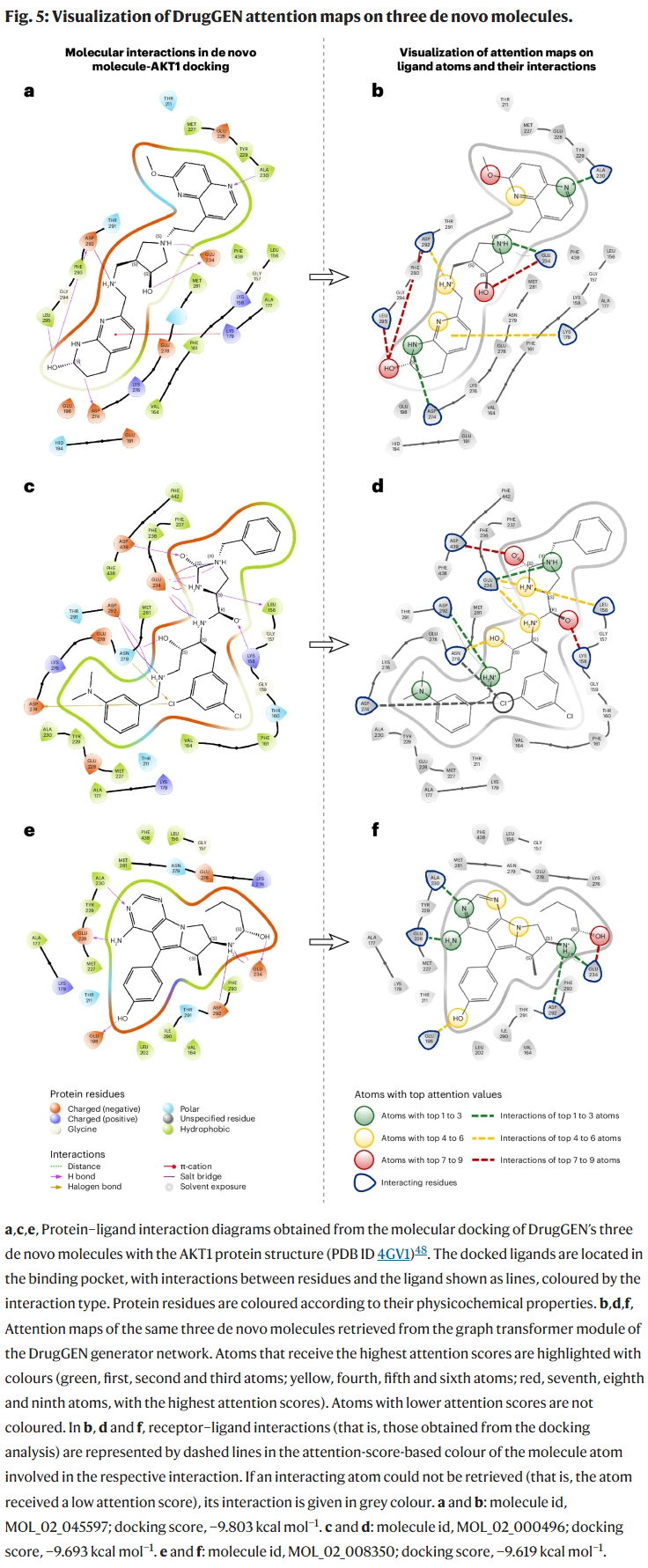
讨论
DrugGEN 的优势在于:
- 融合图 Transformer 与 GAN,实现端到端的靶点特异性分子生成;
- 在基准测试与靶点对接中均表现优异,优于现有模型;
- 具有较强的解释性,能识别关键结合原子;
- 在实验中验证了生成分子的实际抑制活性。
研究人员强调,DrugGEN 直接从真实分子图中学习映射关系,减少了基于预测值优化带来的误差累积。其生成的分子规模(平均 33 个重原子,最大 45 个)接近真实药物,增强了结果的可用性。未来,研究人员计划扩展到更多靶点,引入分子片段级别的生成方式,并结合约束优化与多模态生物医学知识图谱,以提升设计的精度与可控性。
整理 | DrugOne团队
参考资料
Ünlü, A., Çevrim, E., Yiğit, M.G. et al. Target-specific de novo design of drug candidate molecules with graph-transformer-based generative adversarial networks. Nat Mach Intell (2025).
https://doi.org/10.1038/s42256-025-01082-y
内容为【DrugOne】公众号原创|转载请注明来源
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2025-09-17,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读

