Nat. Commun. | 超大规模虚拟筛选驱动孤儿受体GPR139 强效激动剂发现 !
Nat. Commun. | 超大规模虚拟筛选驱动孤儿受体GPR139 强效激动剂发现 !

DrugOne
发布于 2026-01-13 15:42:12
发布于 2026-01-13 15:42:12
在神经精神疾病治疗领域,孤儿G蛋白偶联受体(GPCR)始终是极具潜力却充满挑战的药物靶点。GPR139作为中枢神经系统特异性表达的孤儿受体,其与精神分裂症、抑郁症、注意力缺陷多动障碍(ADHD)等疾病的密切关联,使其成为业界关注的焦点,但其内源性配体和功能仍属未知。
近日,发表于《Nature Communications》的一项跨国合作研究(瑞典、丹麦、中国等团队联合开展),通过“高分辨率结构解析+超大规模虚拟筛选+结构导向优化”的整合策略,成功破解了GPR139配体发现的核心难题,为该类靶点的药物研发提供了兼具科学性与实用性的范式。
本文将从研究背景、核心技术路径、关键发现维度,对该研究进行专业且全面的深度解读。
一、研究背景:孤儿GPCR药物研发的困境与GPR139的独特价值
1. 孤儿GPCR的研发瓶颈
GPCR家族是人体最大的膜蛋白家族,尽管仅占人类可成药基因的15%,却承载了34%以上已批准药物的作用靶点。然而,在非嗅觉GPCR中,仍有超过100个被归类为“孤儿受体”——其内源配体与生理功能尚未明确。这类受体的研发面临双重挑战:一是缺乏明确的功能学依据,难以设计针对性筛选策略;二是传统高通量筛选命中率低、配体活性重现性差,导致多数孤儿受体的治疗潜力未能被充分挖掘。
2. GPR139的靶点特性与研究基础
GPR139作为Class A孤儿受体,自2005年被发现以来,其独特的生物学特征逐步受到关注:
- 表达特异性:仅在中枢神经系统(CNS)中表达,尤其在缰核、中脑等与情绪调节、认知功能、运动控制相关的脑区高度富集,而缰核正是精神分裂症、抑郁症等疾病的核心病理区域。
- 功能关联性:GPR139基因变异与精神分裂症、ADHD直接相关,敲除该基因的小鼠会出现类精神分裂症症状;其信号通路与多巴胺、阿片类神经调节系统交叉,进一步暗示其在神经精神疾病中的关键作用。
- 研发现状:此前虽有候选药物(如TAK-041)进入临床试验用于治疗精神分裂症相关快感缺失,但因疗效不足未能通过II期试验,核心原因在于缺乏高活性、高特异性的配体工具分子,且对受体信号传导机制的理解不够深入。
3. 技术突破的必要性
传统配体发现依赖内源化合物库筛选或同源受体序列比对,难以适配GPR139复杂的结合口袋结构。而冷冻电镜(cryo-EM)技术的成熟的大规模化学库的可及性,为结构导向的配体发现提供了可能——本研究正是基于这一技术背景,探索“结构解析+虚拟筛选”在孤儿GPCR中的应用价值。
二、核心技术路径:从结构解析到体内验证的全链条设计
研究团队构建了“结构基础-虚拟筛选-优化验证-机制解析-体内活性”的闭环研究体系,每一步均体现了严谨的科学设计与技术创新:
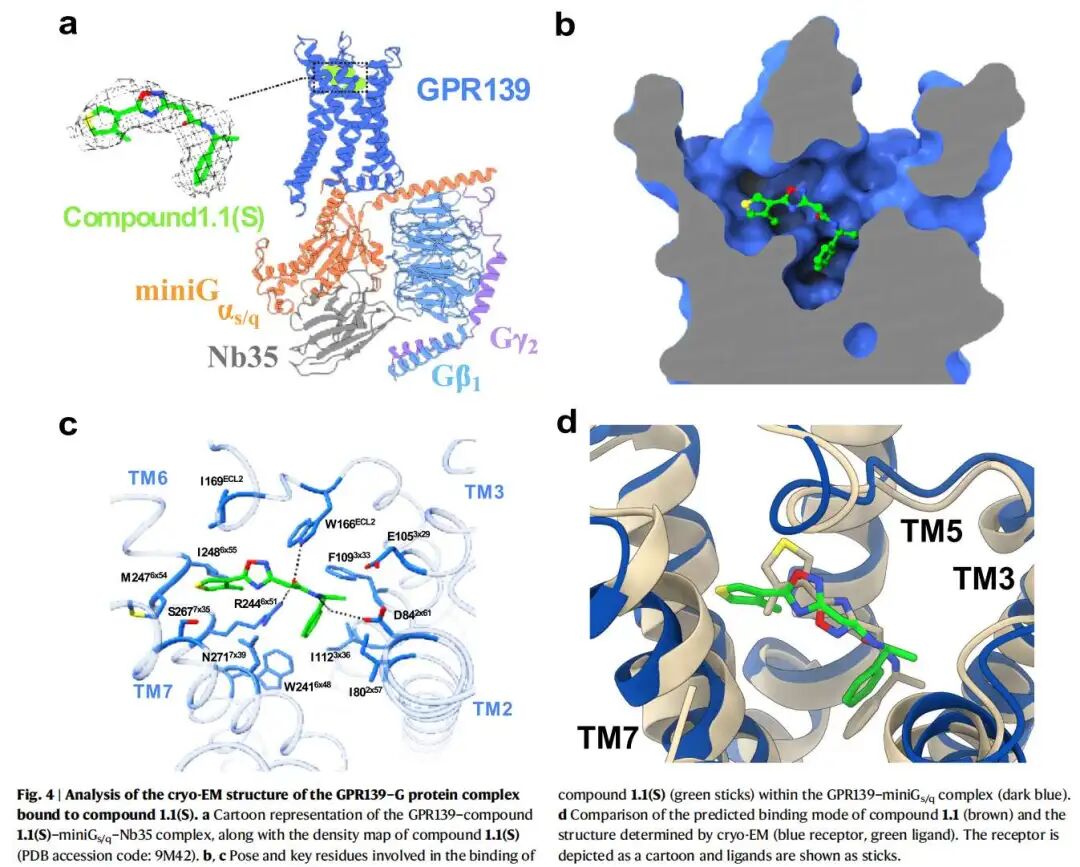
1. 结构基础:高分辨率GPR139-配体复合物解析
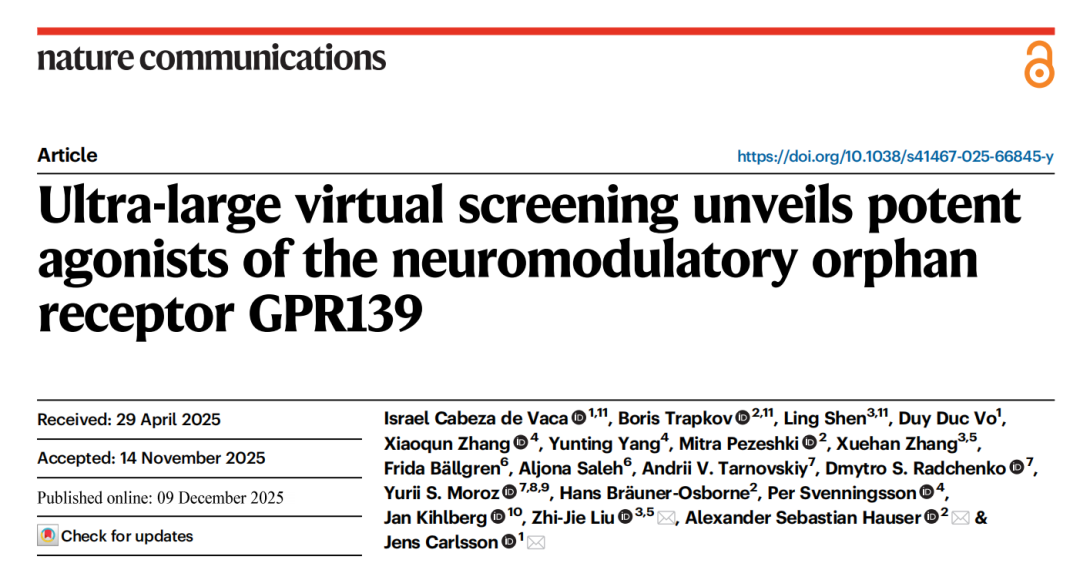
研究以GPR139与已知合成激动剂JNJ-63533054的cryo-EM复合物结构(PDB: 7VUG)为起点,明确了受体的正构结合口袋特征:该口袋深度埋藏,与其他Class A GPCR的结合位点存在重叠,但在形状和极性组成上具有独特性,为特异性配体设计提供了精准的结构模板。
2. 超大规模虚拟筛选:亿级化合物库的高效筛选
- 筛选规模:采用ZINC15数据库中的2.35亿个类先导化合物(cLogP≤3.5,分子量≤350 Da),覆盖未被合成的全新骨架结构。
- 筛选工具:使用DOCK3.7软件进行分子对接,通过只考虑配体柔性的算法采样每个化合物平均3933种取向和178种构象,累计处理超过200万亿个复合物构象,计算量相当于单个CPU核心连续运行6年。
- 筛选流程:
- 初筛:基于 docking 得分筛选Top 300,000化合物(占总库0.12%);
- 去重与去干扰:剔除与已知GPR139配体高相似(Tc>0.5)及含实验干扰结构的化合物;
- 聚类与可视化:基于拓扑相似性聚类为13106个簇,选取前1500个簇中心进行结合模式可视化人工审查;
- 候选化合物合成:最终选取68个结构多样的化合物进行定制合成。
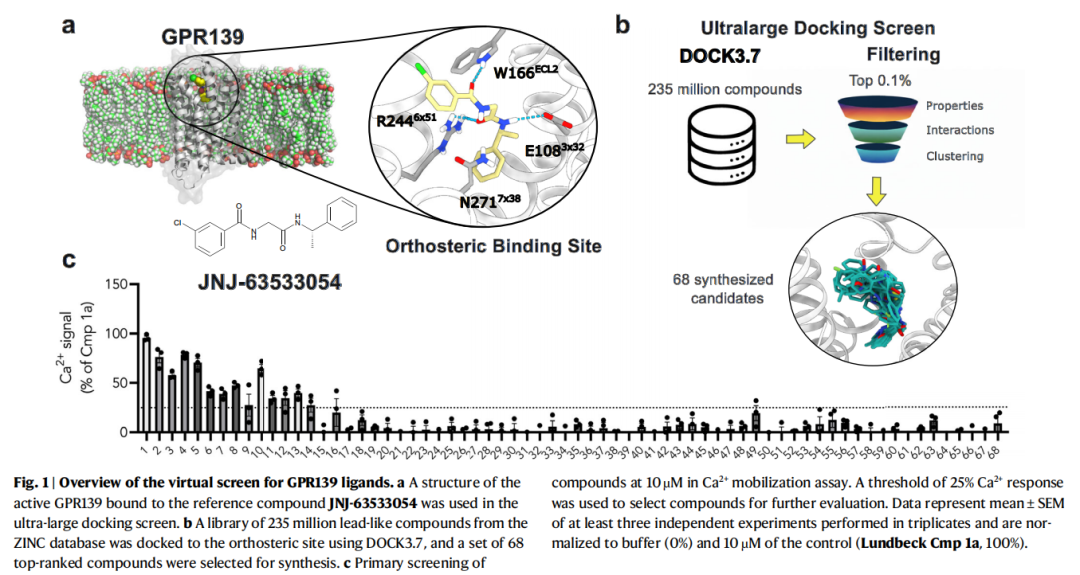
3. 配体优化:结构导向的构效关系(SAR)探索
针对初筛获得的最强效且骨架在药物发现中似乎尚未被探索的化合物(化合物1,EC₅₀=160 nM),进行两轮结构优化:
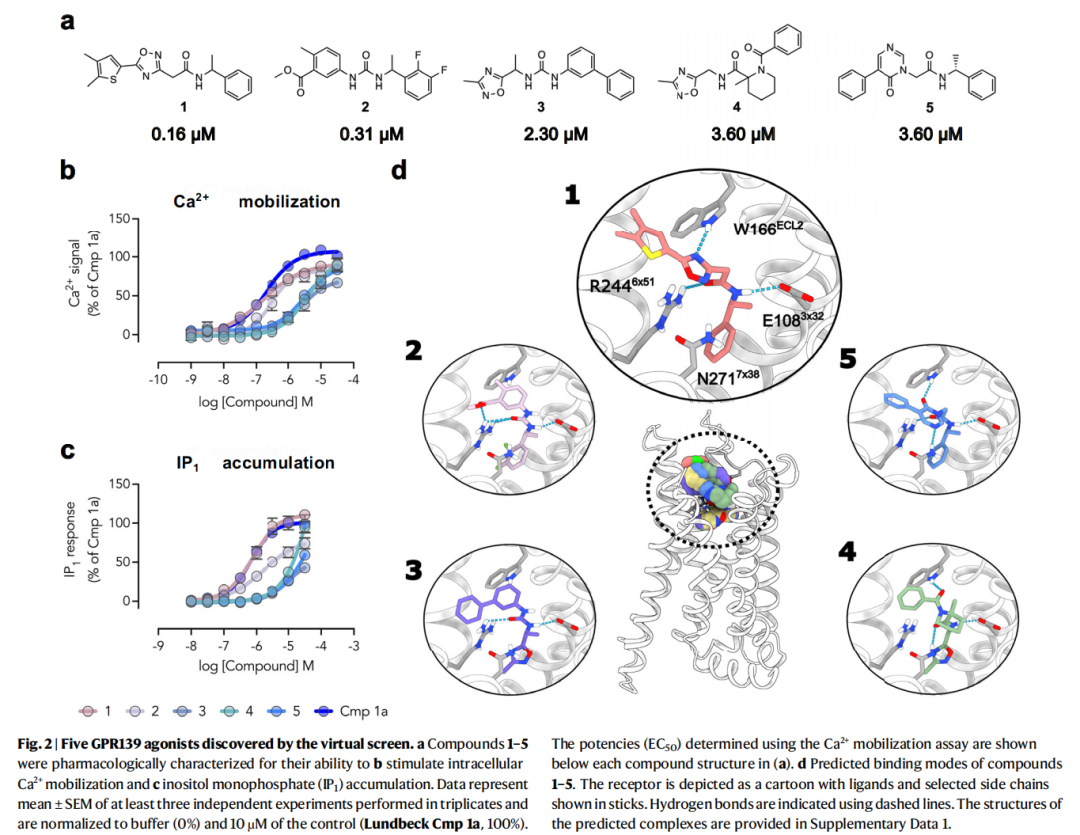
- 优化策略:以cryo-EM结构为指导,聚焦化合物1的噻吩环、恶二唑环等核心骨架,从Enamine的340亿个按需合成化合物库中搜索7574个类似物;
- 合成与筛选:分子对接后选取44个代表性类似物进行合成,通过钙动员实验和肌醇单磷酸(IP₁)积累实验验证活性;
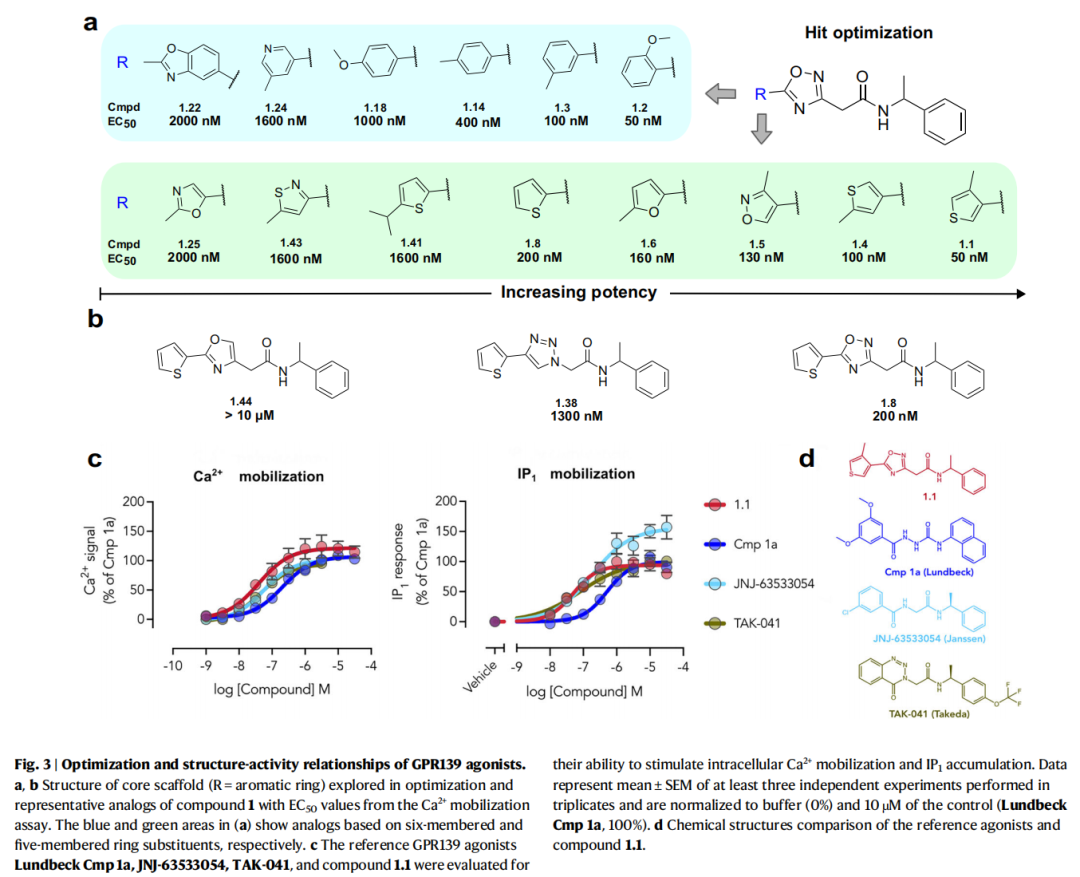
- 关键发现:明确了影响活性的核心结构特征,如4位甲基取代可提升3倍活性(化合物1.1,EC₅₀=50 nM),恶二唑环是维持活性的关键骨架,而吡啶环取代会导致活性显著下降。
4. 机制验证:结合模式与信号通路解析
- cryo-EM验证:解析了GPR139与优化后最有潜力的化合物1.1(S-对映体)的复合物结构(PDB: 9M42,分辨率3.2 Å),证实了对接预测的结合模式(配体RMSD=2.9 Å),且发现化合物1.1(S)可诱导结合口袋的胞外区扩张,形成独特的水介导氢键相互作用。
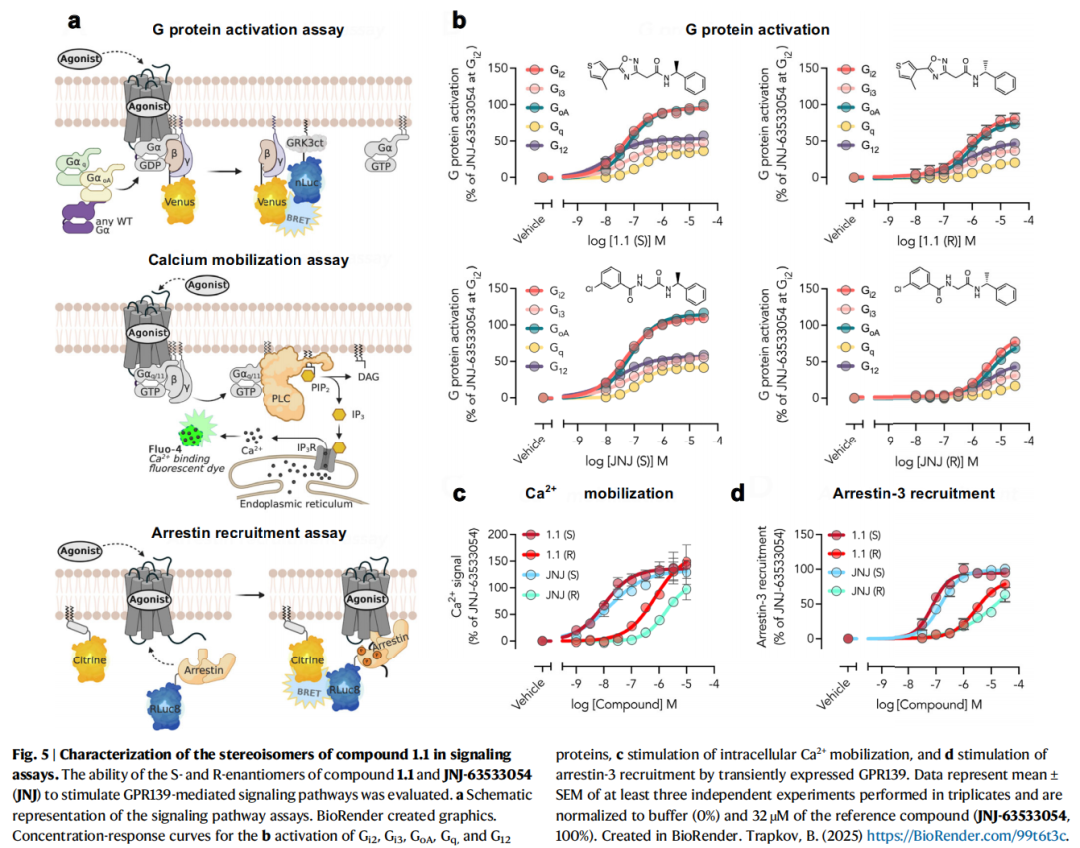
- 信号通路表征:通过BRET实验证实,GPR139可激活Gᵢ₂、Gᵢ₃、Gₒₐ、G_q、G₁₂多种G蛋白亚型,其中G₁₂蛋白偶联为首次报道,拓展了对该受体信号传导网络的认知。
5. 体内活性验证:血脑屏障穿透与行为学效应
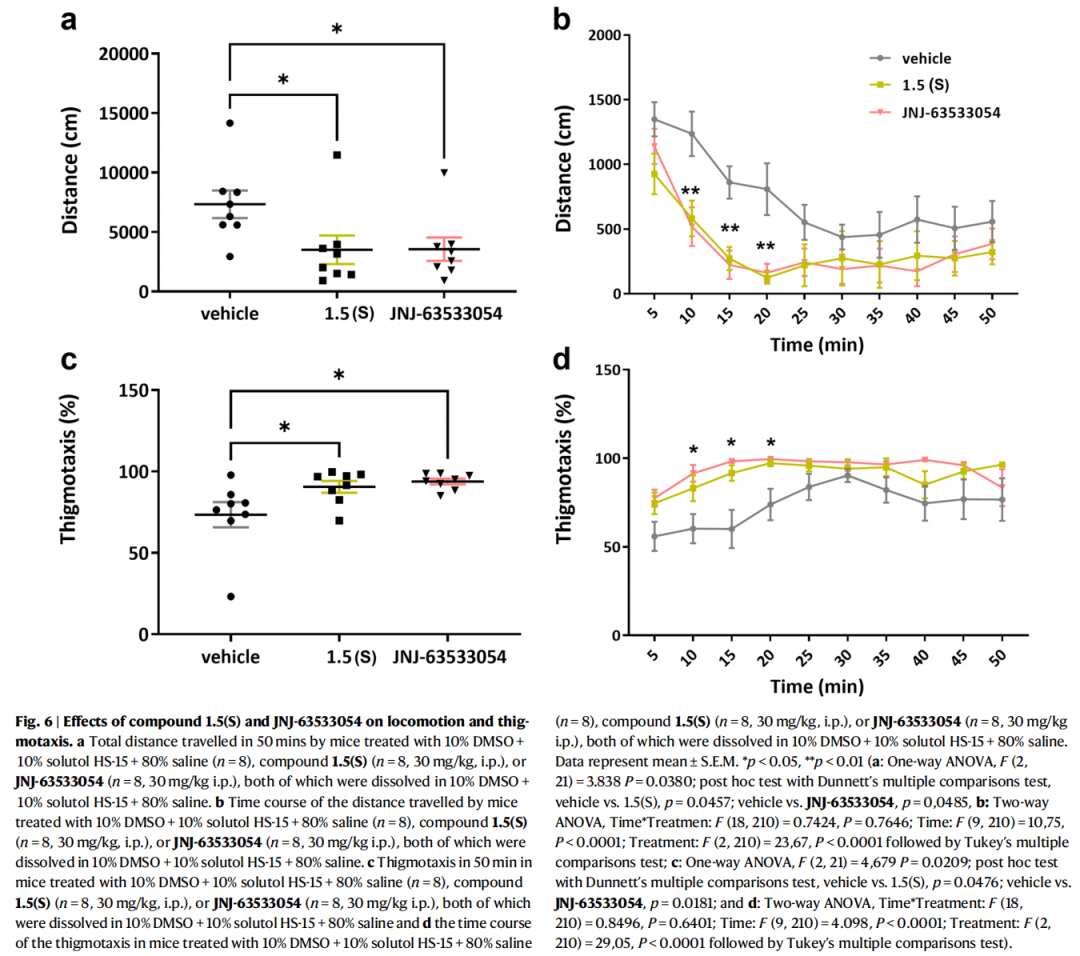
选取代谢稳定性更高的化合物1.5(S)(CL_int=46 μL/min/mg,溶解度=24 μM)进行小鼠旷场实验:
- 给药方式:30 mg/kg腹腔注射,1小时后脑内浓度达4.8 ± 1.0 μM,超过体外活性EC₅₀值,证实其可穿透血脑屏障;
- 行为学效应:化合物1.5(S)可显著降低小鼠总移动距离,增加外周停留时间(触壁行为),表现出与参考激动剂JNJ-63533054相似的 locomotion 调节和焦虑样行为影响,验证了其体内生物学活性。
6. AI模型评估:AlphaFold3在孤儿GPCR中的应用局限
研究同时测试了AlphaFold3(AF3)预测受体-配体复合物结构的能力:
- 已知靶点:AF3对GPR139-1.1(S)复合物的预测精度较高(配体RMSD=2.7 Å),但依赖于训练集中包含GPR139相关结构;
- 未知靶点:对5个未纳入训练集的孤儿GPCR-配体复合物,AF3仅能准确预测1个复合物的结合模式,其余4个或结合口袋定位错误(RMSD = 6.3–20.3 Å),或配体构象偏差显著(RMSD=5.7-20.3 Å),表明AI模型在未充分研究的GPCR配体预测中仍存在局限性,实验解析结构仍是不可或缺的基础。
三、关键研究发现:从配体发现到机制创新的多重突破
1. 配体发现:全新骨架的高效激动剂
- 初筛获得5个完全激动剂(EC₅₀=160 nM-3.6 μM),其中化合物1-4的骨架与已知GPR139配体相似度极低(Tc<0.4),化合物2-4的拓扑结构与ChEMBL数据库中所有已知配体差异显著(Tc<0.3),为全新药物骨架的开发提供了起点;
- 优化后化合物1.1(S)的EC₅₀低至50 nM,在稳定表达GPR139的CHO-K1细胞中EC₅₀进一步降至8 nM,是目前已报道的最强效 GPR139激动剂之一,且对M₁受体无交叉活性,特异性优异。
2. 构效关系(SAR):核心结构特征明确
- 噻吩环:4位甲基取代可增强活性, larger 取代基会降低活性,呋喃环取代不影响活性,噻唑环和恶唑环取代会显著降低活性;
- 恶二唑环:是维持活性的关键骨架,替换为三唑环或恶唑环会导致活性下降7-50倍;
- 取代基效应:苯环上的甲基取代活性高于甲氧基取代,2位甲氧基取代可显著提升活性(化合物1.2,EC₅₀=50 nM)。
3. 信号机制:G₁₂蛋白偶联的全新发现
GPR139此前被认为主要通过G_q/11信号通路传导,本研究首次证实其可高效偶联G₁₂蛋白,且G₁₂激活是除钙动员外最显著的信号响应。G₁₂蛋白在神经元迁移、轴突导向及神经递质释放中具有重要作用,且与应激相关神经精神疾病密切相关,这一发现为设计偏向性信号配体提供了新的方向。
4. 技术范式:结构导向+超大规模筛选的有效性验证
本研究在挑战性更大的GPR139靶点的筛选命中率达7%,是传统高通量筛选的数十倍,且较此前GPR139虚拟筛选研究的命中率提升2倍,证实了“高分辨率结构+亿级化合物库”模式在孤儿GPCR配体发现中的优势——即使对于结合口袋复杂、内源性配体不明的靶点,仍能高效挖掘全新结构的活性配体。
总结
该研究通过整合前沿结构生物学、超大规模虚拟筛选和精密药理学技术,成功实现了GPR139强效激动剂的发现与优化,不仅为神经精神疾病药物研发提供了全新的先导化合物和靶点工具,更建立了孤儿GPCR配体发现的创新范式。其核心价值在于证实:即使对于内源配体不明、结构复杂的孤儿受体,通过“高分辨率结构+亿级化学库筛选”的组合策略,仍能高效突破配体发现的瓶颈。
参考文献:Cabeza de Vaca, I., Trapkov, B., Shen, L. et al. Ultra-large virtual screening unveils potent agonists of the neuromodulatory orphan receptor GPR139. Nat Commun 17, 129 (2026).
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2026-01-12,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读
目录

