Nature | RFdiffusion: David Baker 团队打造的原子级抗体从头设计新范式
Nature | RFdiffusion: David Baker 团队打造的原子级抗体从头设计新范式

DrugOne
发布于 2025-11-17 21:00:15
发布于 2025-11-17 21:00:15
DRUGONE
抗体在现代医学中扮演核心角色,但目前尚无方法能够在完全计算机模拟的条件下设计出新的、针对特定表位的抗体。现有抗体发现依赖免疫实验、随机文库筛选或直接从患者体内分离抗体。研究人员展示了通过结合经精调的 RFdiffusion 网络与酵母展示筛选,可以从头生成针对用户指定表位、具有原子级精度结合能力的抗体,包括可变重链(VHH)、单链抗体片段(scFv)以及完整抗体。研究人员在四种与疾病相关的表位上对生成的 VHH 结合物进行了实验验证。冷冻电镜结果确认了针对流感血凝素与艰难梭菌毒素 B(TcdB)的设计 VHH 的结合构象,其中针对流感的 VHH 的高分辨率结构进一步验证了互补决定区(CDRs)设计的原子级准确性。虽然初始计算设计的亲和力有限(纳摩尔至百纳摩尔级别),但经 OrthoRep 平台亲和力成熟后,生成的抗体能达到个位数纳摩尔的结合强度并保持特定表位选择性。研究人员进一步展示了针对 TcdB 和 PHOX2B 肽–MHC 复合物的 scFv 从头设计。冷冻电镜结果确认了两种 TcdB scFv 的结合构象,其中一个高分辨率结构显示所有六个 CDR 环的构象设计均达到原子级精度。该工作建立了一个可在结构和表位层面实现原子级精度计算设计、筛选与表征抗体的系统化框架。

抗体是最主要的蛋白质治疗药物类别,目前全球已批准超过 160 种抗体疗法,预计未来五年市场规模将达 4450 亿美元。抗体开发通常包括两个阶段:(1)发现能结合特定表位的抗体;(2)进行亲和力成熟和临床优化。当前识别表位特异性抗体仍主要依赖动物免疫或文库筛选,这些方法耗时、费力且不一定能获得针对治疗相关表位的抗体。
计算抗体设计的研究多集中于第二阶段,如采样替代 CDR 环以提高亲和力或利用序列设计优化结合界面。近期基于深度学习的结构与序列模型虽能生成抗体变体,但均依赖已有结合抗体作为起点。相反,能够直接从零生成表位特异性抗体的计算方法仍然缺失。
RFdiffusion 及相关研究在蛋白结合体的从头设计上取得了显著进展,但此前模型主要依赖规则的二级结构(螺旋或 β 链)界面,无法设计依赖 CDR 环的抗体。因此,研究人员假设:若在抗体结构上精调 RFdiffusion,则有可能实现基于 CDR 环介导的抗体从头设计。
RFdiffusion 的抗体设计训练
RFdiffusion 基于 AlphaFold2 的框架表示,将蛋白骨架的原子坐标与刚体取向嵌入模型中,并通过噪声注入与去噪学习生成蛋白三维结构。研究人员在训练中加入抗体复合体结构,通过“模板通道”输入框架结构信息,使模型能够在保持框架不变的情况下生成新的 CDR 环与抗原结合构象。模型同时接受“热点位点”作为表位约束,从而在推理时生成针对特定位点的抗体结构。
通过这种训练方式,RFdiffusion 能生成结构与输入框架匹配、且能针对指定表位形成新型 CDR 环的抗体结构。随后研究人员利用 ProteinMPNN 设计 CDR 环的氨基酸序列,并通过精调的 RoseTTAFold2 进行结构预测与筛选。
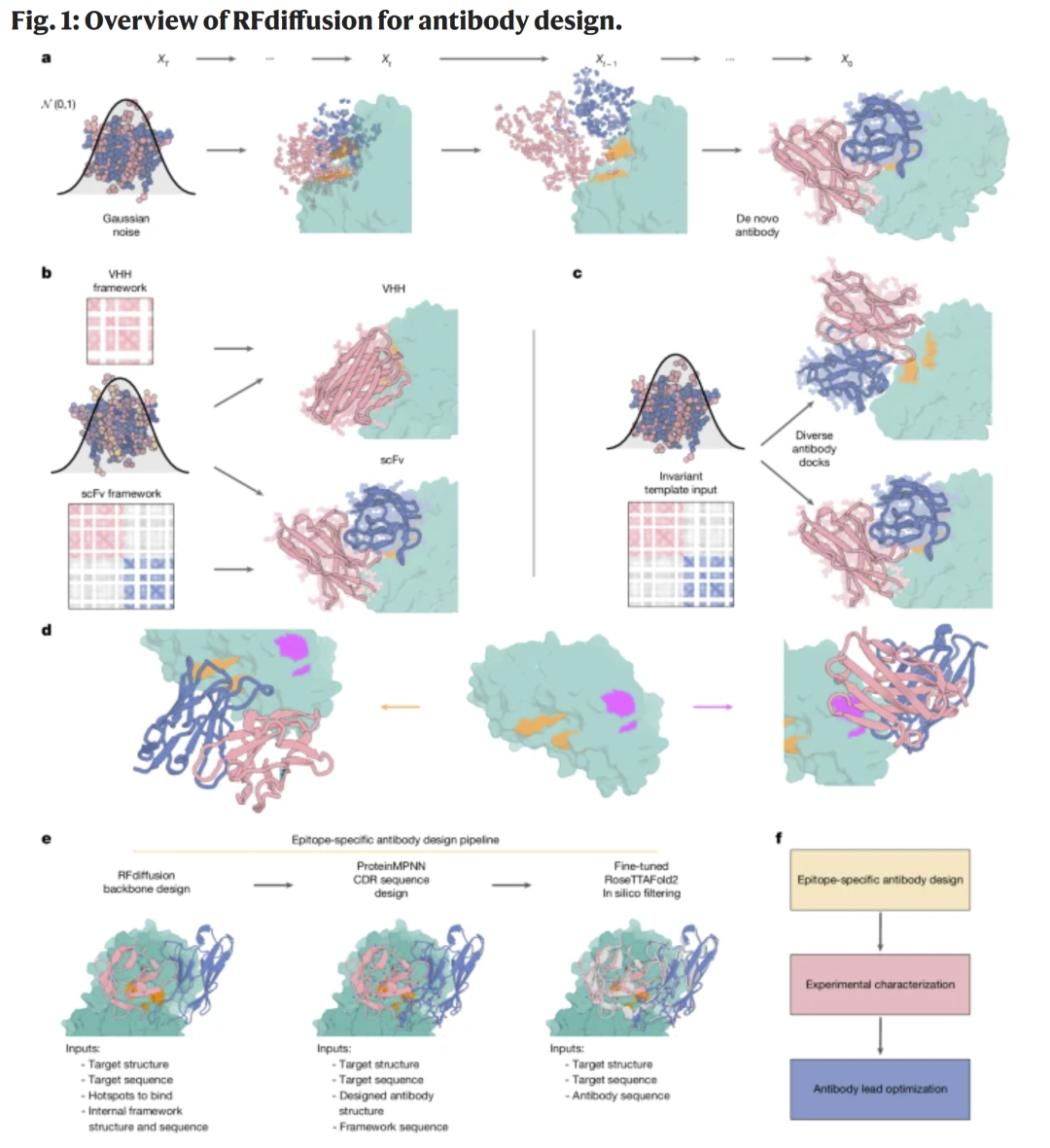
图1 | RFdiffusion 抗体设计框架与整体流程
模型验证与筛选
传统设计流程往往产生大量候选结构,研究人员通过预测模型与设计模型之间的一致性(self-consistency)来评估实验可行性。然而,AlphaFold2 难以准确预测抗体–抗原复合体结构,因此研究人员精调了 RoseTTAFold2(RF2)用于抗体结构验证。通过在训练中引入抗原结构与表位信息,精调后的 RF2 能更准确地区分真实复合物与伪结构,并对设计结果进行筛选。
应用于 RFdiffusion 生成的 VHH 时,RF2 成功预测出大量与设计一致的结合模式,表明此筛选流程可显著提升实验成功率。

拓展图2 | RFdiffusion 精调与表位约束的结构生成机制
VHH 的设计与表征
研究人员首先聚焦单域抗体(VHH)的设计,选择人源化框架(h-NbBcII10F-GLA)作为基础,针对多种疾病相关靶点(如艰难梭菌毒素 B、流感血凝素、RSV、SARS-CoV-2 RBD、IL-7Rα)生成 VHH。经计算筛选后,部分设计通过酵母表面展示(约 9000 个/靶点)或 E. coli 表达结合 SPR 检测。筛选结果显示,生成的 VHH 能以纳摩尔级亲和力结合目标表位,并与天然抗体序列显著不同。
针对流感血凝素的 VHH 具有 78 nM 的解离常数(Kd),艰难梭菌毒素 B 的设计则能以 260 nM 亲和力结合目标表位,并具备表位特异性,不与同源毒素发生交叉反应。该结果证明了 RFdiffusion 能够生成特异且功能性的表位结合体。
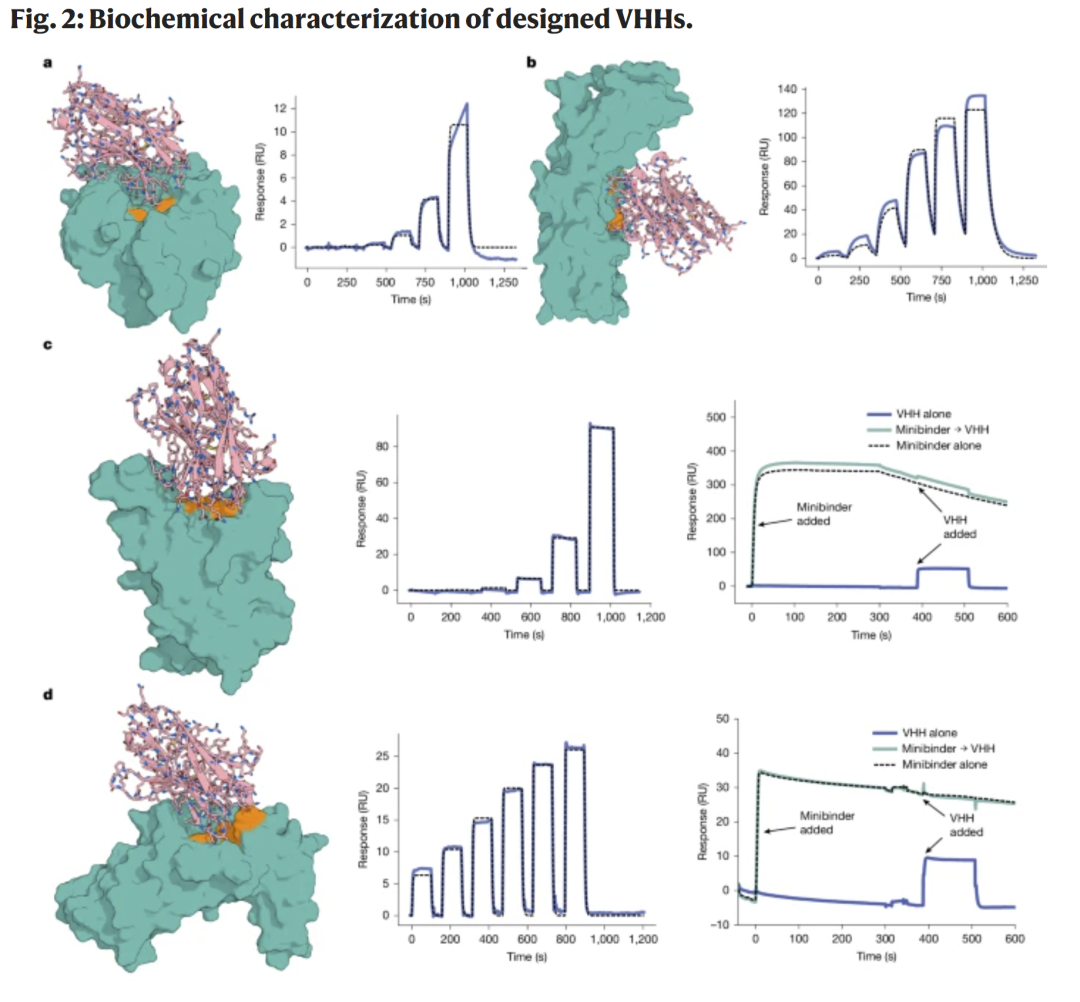
图2 | VHH 的设计与验证
冷冻电镜结构验证
冷冻电镜分析揭示,设计的流感血凝素结合 VHH(VHH_flu_01)在三聚体结构中的结合角度和构象与模型预测高度一致,整体骨架 RMSD 为 1.45 Å,CDR3 区域 RMSD 为 0.8 Å,验证了原子级精度。类似地,针对 TcdB 的 VHH 在 4.6 Å 分辨率下显示与设计模型高度吻合,经 OrthoRep 亲和力成熟后仍保持相同的结合模式。
此外,针对 SARS-CoV-2 的设计也验证了特定位点结合能力,尽管其结合方向与预测略有偏差。

图3 | 从头生成的 VHH 抗体设计与结构验证
六个 CDR 的 scFv 从头设计
在成功生成 VHH 后,研究人员进一步测试了同时设计重链与轻链(共六个 CDR)的 scFv。由于基因合成与配对难度更高,研究人员开发了分步组装与结构知晓的重–轻链组合策略,以克服单一 CDR 设计误差带来的失败。
实验表明,结构知晓的组合文库能高效识别表位特异性 scFv,而随机配对几乎不产生有效结合体。针对 TcdB 的两个 scFv(scFv5 与 scFv6)显示出 460 nM 至 72 nM 的亲和力,转化为 IgG1 后仍保持相当结合力,并能与天然受体竞争结合。
研究人员还成功设计了针对 PHOX2B–HLA-C*07:02 复合物的 scFv,能够特异识别肽段关键残基 R6,展现了该方法在 MHC–肽复合物靶向中的潜力。
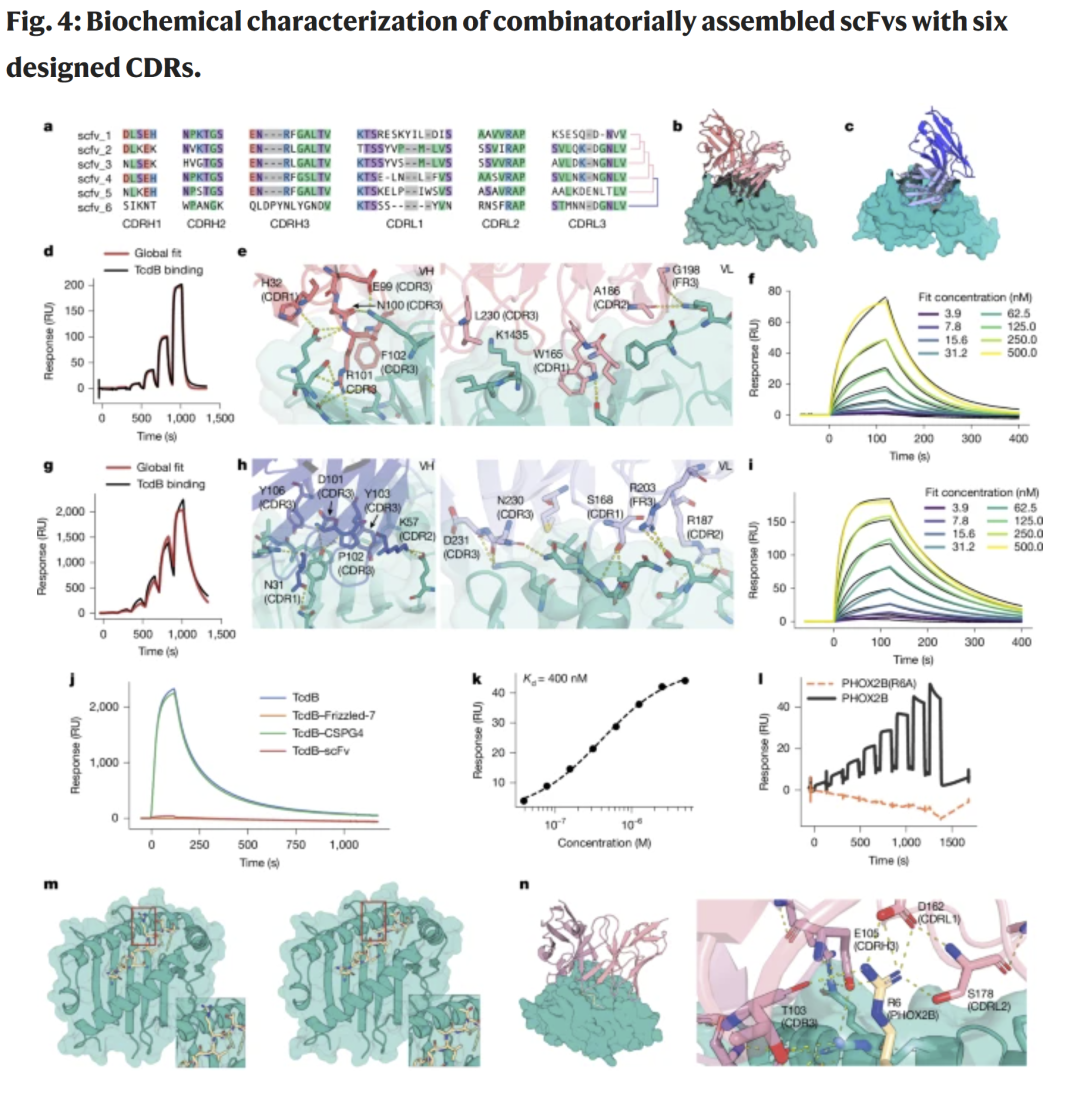
图4 | scFv 的从头生成、筛选与结构验证
原子级精度的 scFv 结构验证
冷冻电镜结构(3.6 Å)显示 scFv6 在艰难梭菌毒素 B 上的结合位点与预测完全一致,六个 CDR 的骨架 RMSD 均小于 1 Å。另一 scFv5 在 6.1 Å 分辨率下同样验证了预期的结合模式。整体结果表明 RFdiffusion 能以原子级精度生成双链抗体的结合界面。
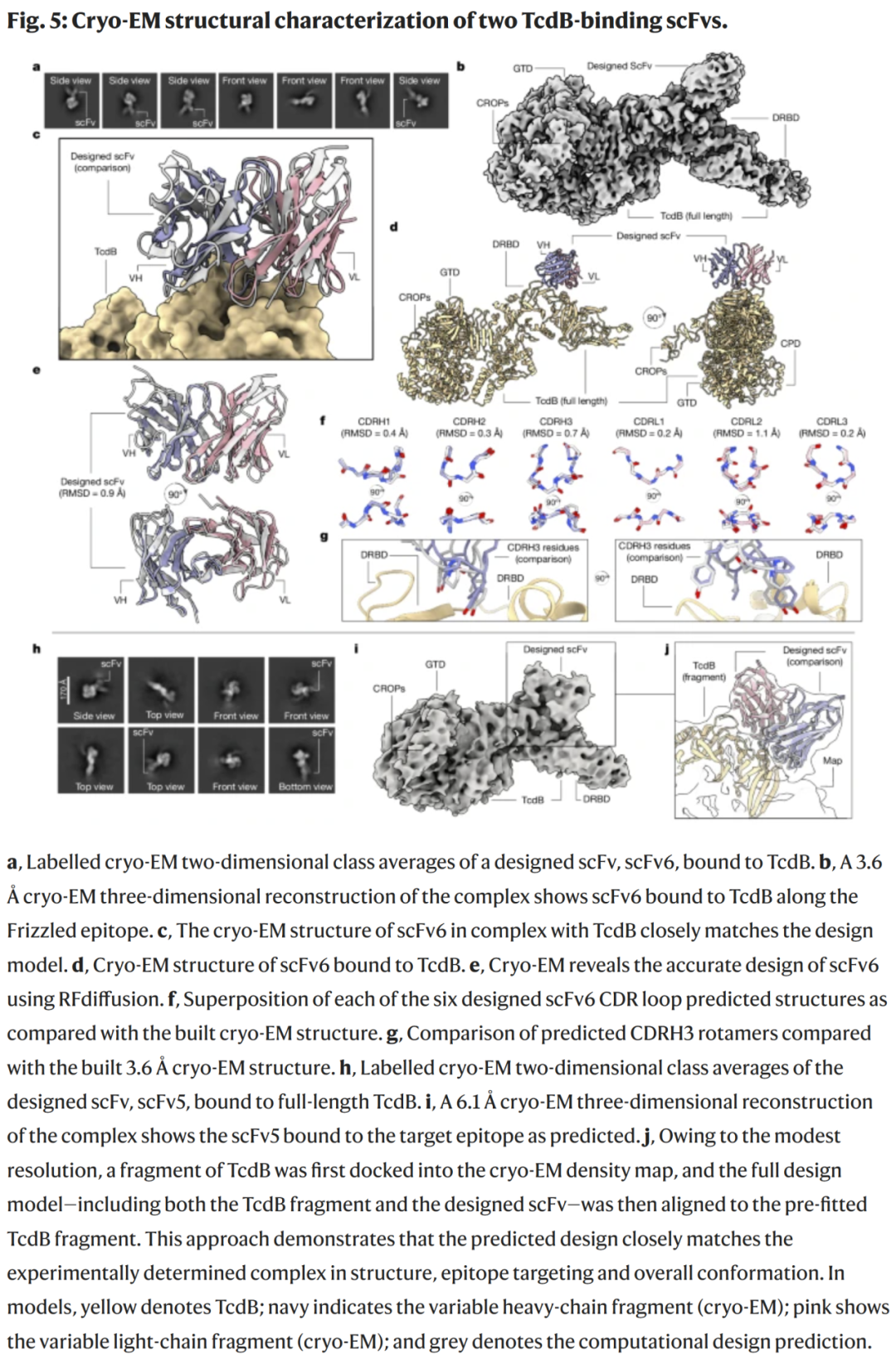
图5 | 结构精度验证与筛选策略改进
提升成功率的策略
尽管研究人员实现了从头抗体设计的突破,但实验成功率仍然偏低。后续研究显示,结合 AlphaFold3 的界面置信度指标(ipTM)可有效预测设计成功与否。回溯分析表明,若采用 AlphaFold3 筛选,可显著减少失败案例并提高整体成功率。
讨论
该研究首次系统展示了利用深度生成模型实现针对特定表位的抗体从头设计。冷冻电镜验证的流感与艰难梭菌结合体均达到了原子级一致性,表明该框架能在无模板条件下准确生成 CDR 构象与结合方向。RFdiffusion 的结构化设计与酵母展示筛选、OrthoRep 亲和力成熟相结合,为抗体发现提供了全新的计算—实验闭环流程。
研究人员指出,未来若结合更新的生成模型与改进的抗体结构预测网络(如 AlphaFold3 或后继模型),有望进一步提升设计成功率,并在抗体人源化、免疫原性优化及药代动力学改进方面发挥作用。最终,这种结构驱动的从头设计方法将加速抗体药物研发,拓展可成药靶点的范围,并显著降低抗体发现的成本与周期。
整理 | DrugOne团队
参考资料
Bennett, N.R., Watson, J.L., Ragotte, R.J. et al. Atomically accurate de novo design of antibodies with RFdiffusion. Nature (2025).
https://doi.org/10.1038/s41586-025-09721-5
内容为【DrugOne】公众号原创|转载请注明来源
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2025-11-07,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读

