Pharmacol. Rev.|AI驱动的药物发现:全球顶尖技术平台的发展路径与未来展望
Pharmacol. Rev.|AI驱动的药物发现:全球顶尖技术平台的发展路径与未来展望

DrugOne
发布于 2026-01-26 16:39:26
发布于 2026-01-26 16:39:26
2025年11月10日,格里菲斯大学研究人员在《Pharmacological Reviews》期刊上发表文章,题为“Leading artificial intelligence–driven drug discovery platforms: 2025 landscape and global outlook”。文章系统回顾了AI药物发现这一浪潮前沿的代表性公司、它们近期取得的关键里程碑,以及截至2025年整个领域所发生的结构性变化。

背景
AI已迅速从一种理论上的前景演变为药物发现领域中的现实驱动力。在2020年初,几乎尚无任何AI设计的药物进入人体试验;而到2025年年中,已有数十个由AI推动的新药候选物进入临床试验阶段,这一进展堪称飞跃式发展。以AI为动力的发现引擎正在取代以人工为主、劳动密集型的研发流程,从而压缩时间周期、拓展化学与生物学搜索空间,并重新定义现代药理学的速度与规模(图1)。然而,尽管进入临床阶段的速度显著加快,目前尚无任何由AI发现的药物获得监管批准,大多数项目仍停留在早期临床试验阶段。这也引出了一个关键问题:AI是否真正带来了更高的成功率,还是仅仅加速了失败?有必要进行批判性分析,以区分现实的进展与围绕AI技术的过度炒作。
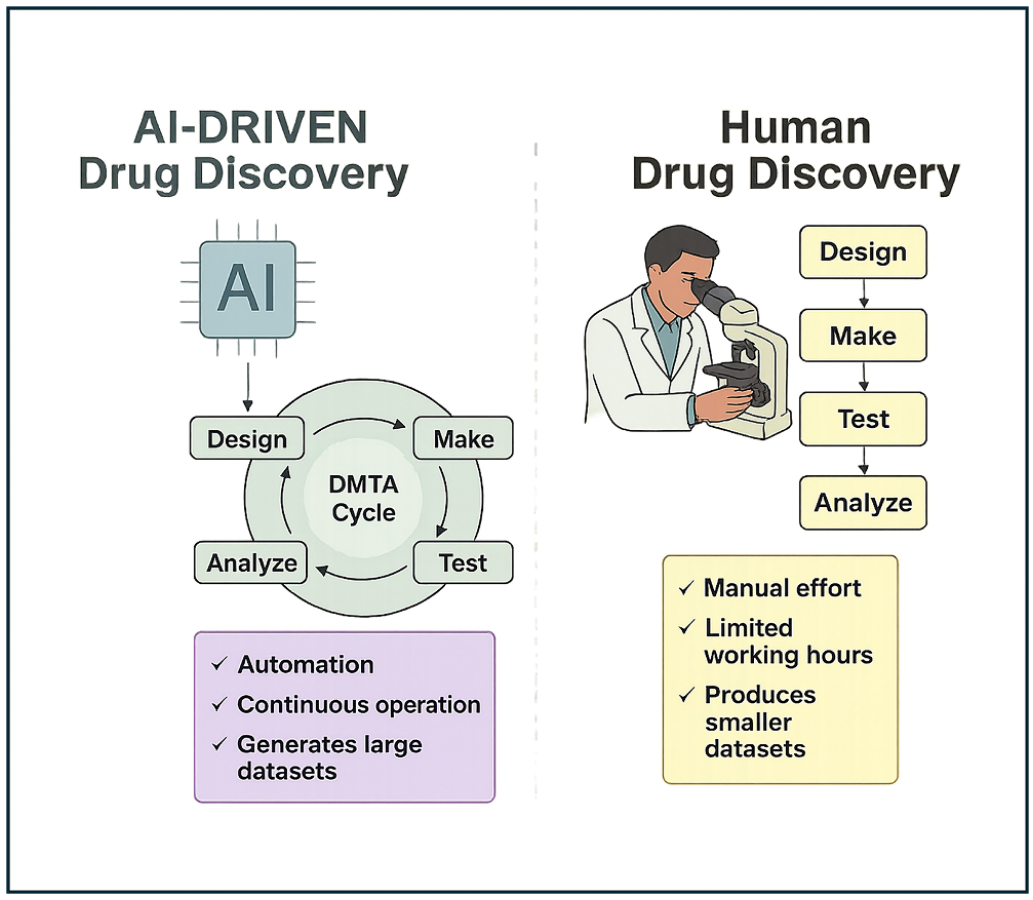
图1 人工驱动与AI驱动药物发现对比
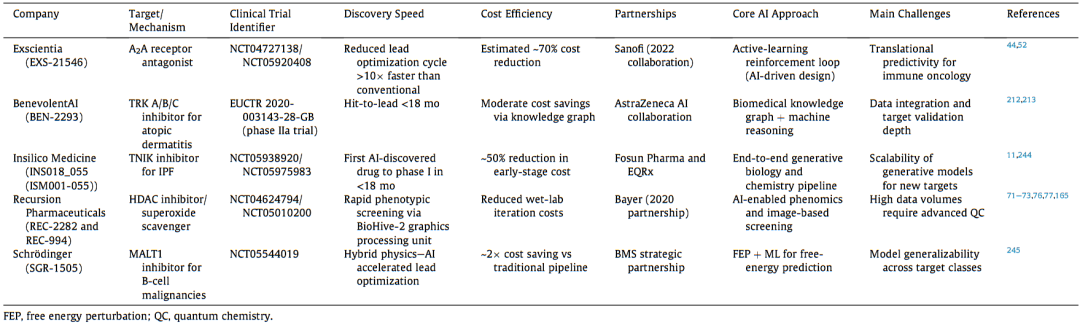
为此,文章考察了五家已成功将创新候选药物推进至临床阶段的领先AI驱动药物发现公司:Exscientia、Insilico Medicine、Recursion、BenevolentAI以及Schrödinger(薛定谔)。这些平台涵盖了多种AI技术路径,包括生成化学、基于物理的分子模拟、表型筛选以及基于知识图谱的靶点发现(图2)。此外,分析了各平台如何在研发全流程中应用AI(图3),其关键技术差异化优势,以及在临床候选物交付方面的历史表现。
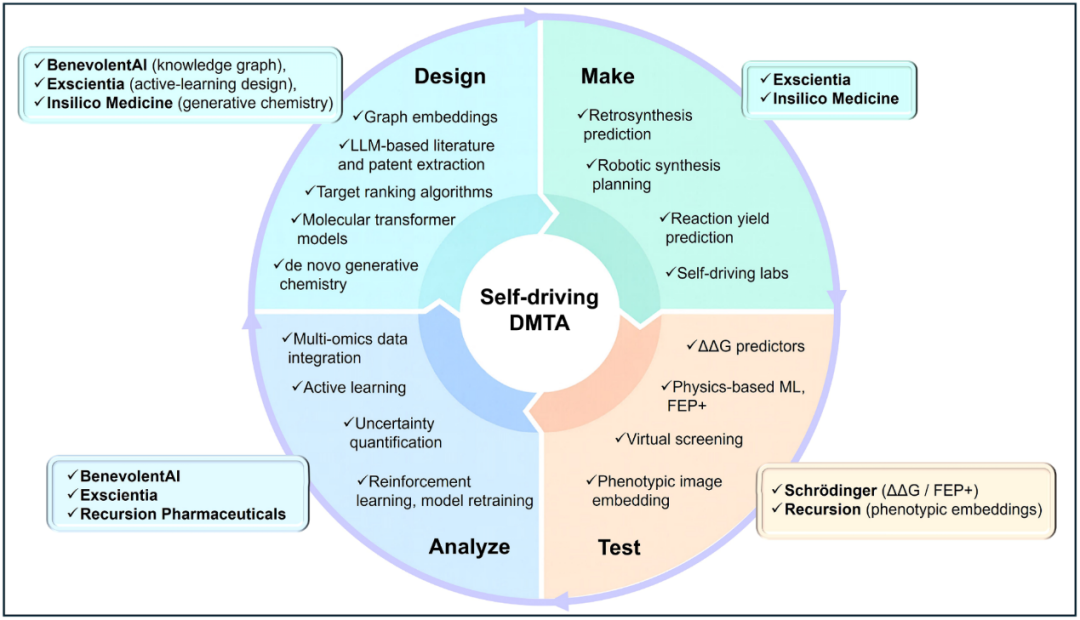
图2 DMTA循环中的核心AI方法
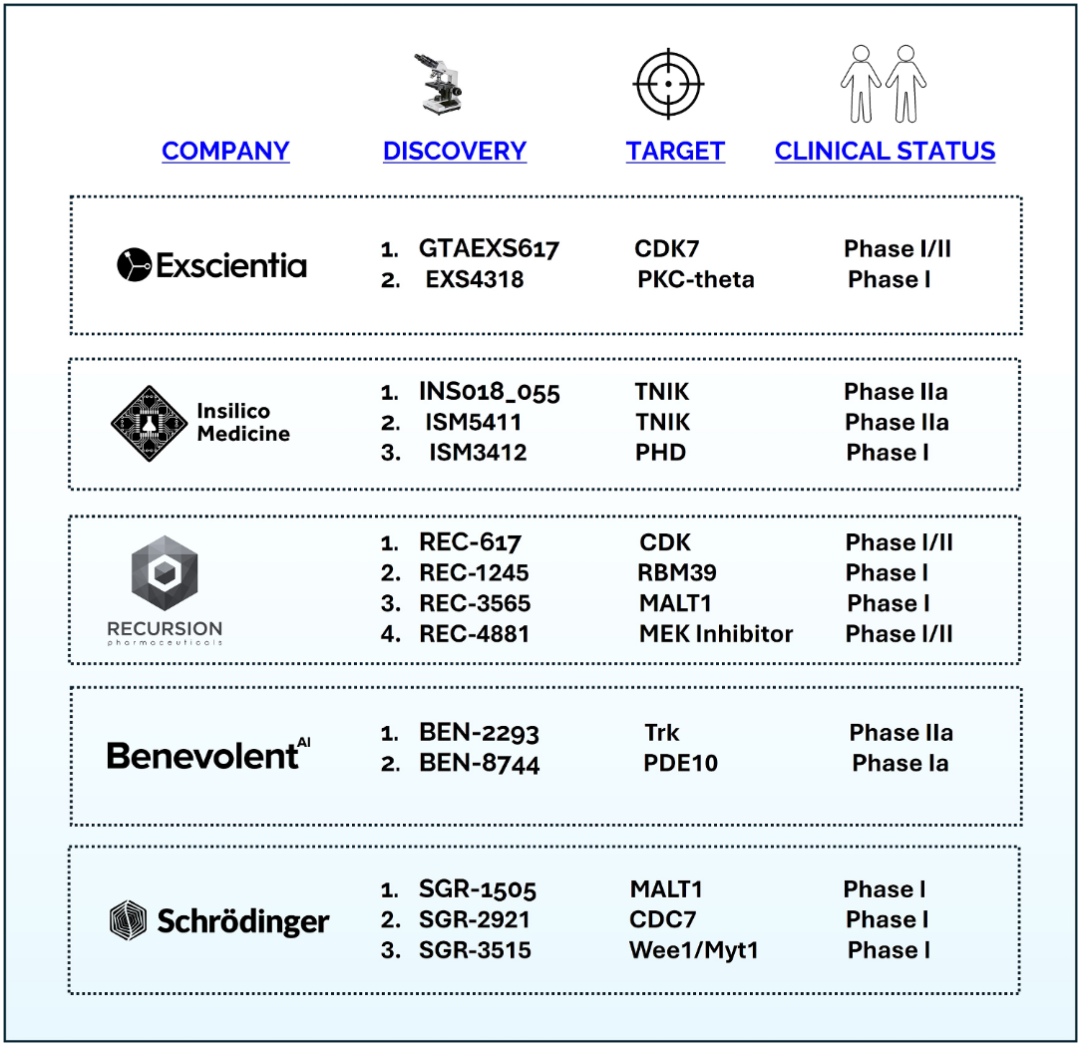
图3 AI驱动药物发现公司的临床阶段管线
随后,作者对2024—2025年期间各公司最新的临床试验结果、合作进展、平台升级及战略调整进行了系统更新。同时,还讨论了自2024年以来涌现的其他新兴AI药物发现参与者,这些公司在技术创新或临床进展方面已表现出显著潜力。文中通过一张对比汇总表,对发现速度、成本效率、临床管线规模及成功率等关键绩效指标进行了横向比较。最后,文章讨论了整体性的监管与伦理问题,包括美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)近期发布的关于AI在药物开发中应用的指导意见,以及透明性、可解释性、数据偏倚和责任归属等方面的挑战。
AI驱动药物发现公司成就与技术路径
Exscientia:生成式设计与“人机协同”方法
Exscientia成立于2012年,总部位于英国牛津,是最早将生成式人工智能应用于小分子药物设计的“先行者”之一。其端到端平台将算法驱动的创造力与人类领域专家知识相结合,这一策略被称为“人机协同”方法,即通过人机协作的方式对新型化合物进行反复的设计、合成与测试。

Exscientia的突出成就之一是率先将AI设计的治疗性药物推进至临床阶段。2020年,其通过算法生成并与日本制药公司住友制药合作开发的用于治疗强迫症的药物DSP-1181(图4),成为全球首个进入Ⅰ期临床试验的AI设计药物。截至2023年,Exscientia已自主或与合作伙伴共同设计了8个进入临床阶段的化合物,其开发速度显著快于行业标准。然而,公司在2023年末宣布进行战略性管线优先级调整,将研发重点收缩至两个核心项目,同时终止或对外合作其他项目。2024年年中,Exscientia扩展了其云计算基础设施,将机器人介导的自动化纳入其中,并推出了一个基于亚马逊云服务(AWS)的集成式AI平台。尽管取得上述进展,Exscientia于2024年8月被Recursion Pharmaceuticals以6.88亿美元收购,双方通过此次并购旨在打造一个“AI药物发现超级平台”。该交易于2024年末完成,将Exscientia在生成化学和设计自动化方面的优势,与Recursion在表型组学和生物数据资源方面的深厚积累相结合。并购完成后,Exscientia的技术能力被整合进统一平台,如利用Exscientia的AI生成新型化合物,再由Recursion在表型分析实验中进行验证。
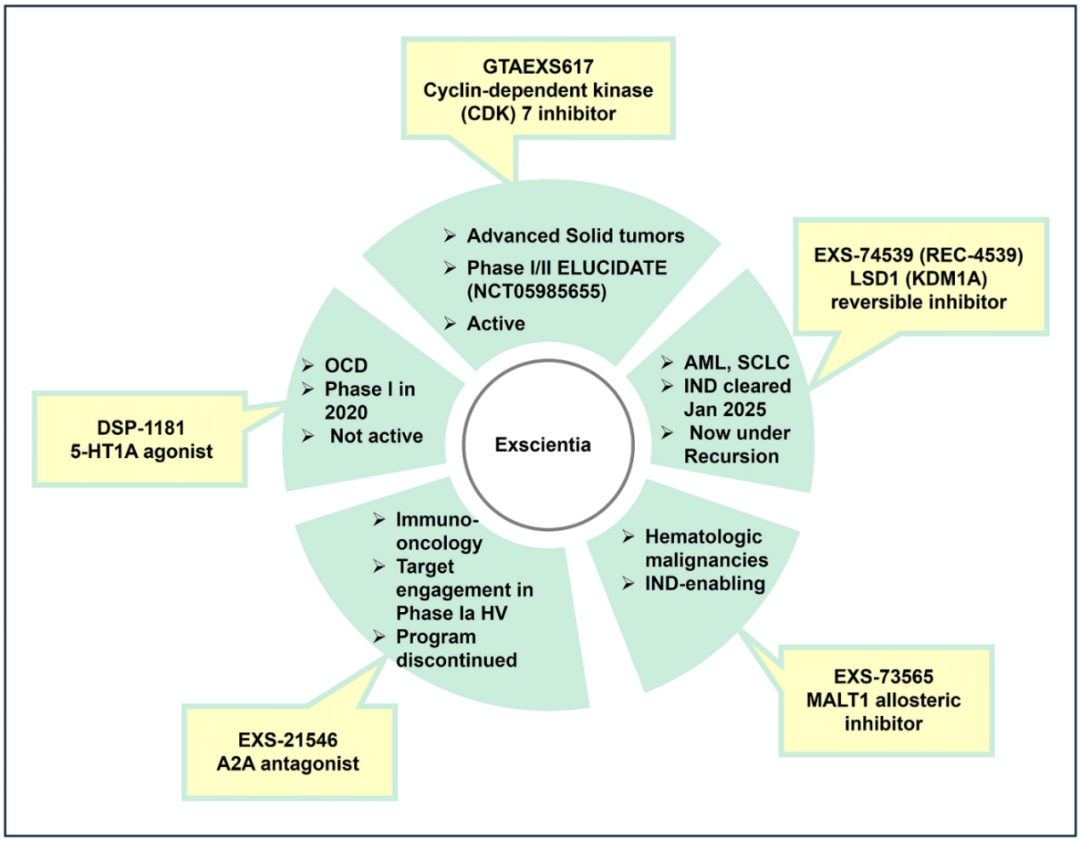
图4 Exscientia小分子项目及2025年状态
截至目前,Exscientia尚无任何AI设计的药物进入Ⅲ期临床试验,但已有多项候选物处于或即将进入Ⅰ/Ⅱ期临床阶段。尽管如此,公司披露的一些指标依然令人瞩目。例如,在一项CDK7抑制剂项目中,仅合成了136个化合物便成功确定了临床候选物,而传统项目往往需要合成数千个化合物。展望未来,在Recursion体系下,Exscientia的生成式AI将与大规模内部湿实验数据相结合,这一组合被认为有望进一步提高成功率。
Recursion Pharmaceuticals:高通量表型驱动的药物发现
Recursion Pharmaceuticals成立于2013年,总部位于美国盐湖城,其采用了一条独具特色的AI技术路径,核心聚焦于表型组学。该技术体系的核心是Recursion操作系统,这是一个将自动化湿实验室基础设施与AI算法深度整合的综合系统。Recursion的自动化实验室每周可开展数百万项实验,这是生物技术行业规模最大的实验室之一。与此同时,该平台还生成了规模极其庞大的关系型数据集,Recursion已积累超过21P字节的图像数据,描绘了数万亿级别的基因—化合物关联关系。
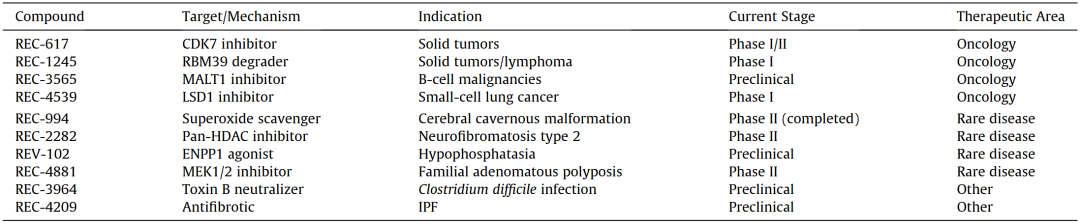
Recursion的“表型优先”策略同时支持药物重定位和全新药物发现。一个具有代表性的案例是REC-994:该化合物此前曾被搁置,但通过Recursion的AI平台被重新识别,显示出可逆转脑海绵状血管畸形相关的细胞缺陷,并成功推进至Ⅱ期临床试验(表1)。另一项早期项目用于治疗2型神经纤维瘤病的REC-2282(表1)也在Ⅱ期临床试验后因疗效不足而被终止。一些挫折促使Recursion在2024-2025年对其研发管线进行重组,将资源集中于具有更强前期数据支持的领域。
表1 Recursion Pharmaceuticals活跃管线及开发阶段
2024年,Recursion建成了名为BioHive-2的专用AI超级计算机,算力达2 exaflops(配备504张NVIDIA H100 GPU)用于训练模型。2025年,Recursion开源了Boltz-2,这是一个拥有十亿参数的生成式模型,用于预测蛋白质三维结构及配体结合亲和力,其精度接近物理模型,但计算速度提高了约1000倍。
表2 Recursion Pharmaceuticals战略合作伙伴及合作性质
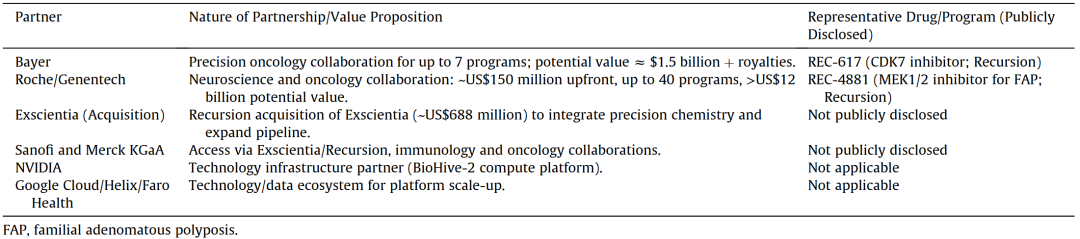
截至2025年年中,Recursion(并购Exscientia后)将在研项目收敛至6个核心开发项目,其中4个用于肿瘤学,2个用于罕见病,同时还突出了与罗氏、赛诺菲、拜耳及默克KGaA 的关键合作项目(表2)。
Insilico Medicine:端到端人工智能与生成式成功案例
Insilico Medicine成立于2014年,总部位于香港和纽约,是端到端AI驱动生物技术公司的典型代表。其综合性Pharma.AI平台由多个相互连接的模块组成:PandaOmics用于AI驱动的靶点识别,通过挖掘组学数据和文献发现新的疾病驱动因子;Chemistry42用于生成式分子设计;InClinico用于临床试验结局预测(表3)。
表3 Insilico Medicine平台、管线及进展

Insilico的标志性成果出现在2021-2022年,其AI系统为特发性肺纤维化(IPF)识别出一个全新的纤维化相关靶点酶TNIK,并针对该靶点生成了一种小分子TNIK抑制剂ISM001-055(现名Rentosertib;图5)。该项目从AI驱动的假设提出到形成临床候选物仅用了约18个月,成为最早实现AI发现靶点+AI设计分子并进入人体试验的案例之一。
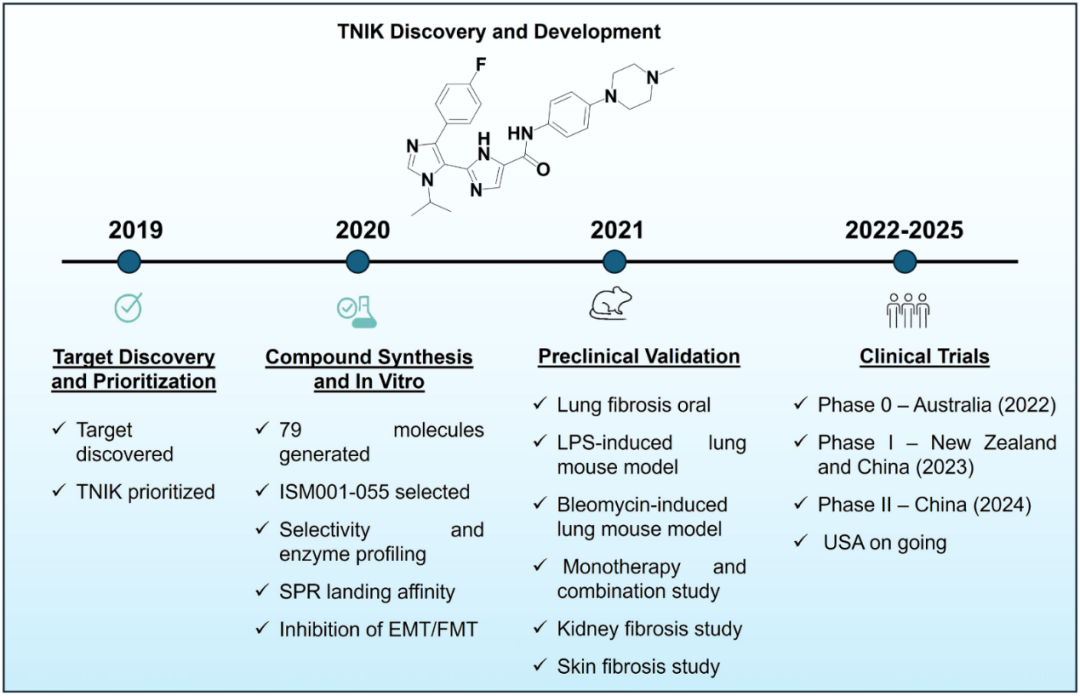
图5 TNIK抑制剂ISM001-055开发历程
BenevolentAI:知识图谱、药物重定位与一个警示性案例
BenevolentAI成立于2013年,总部位于伦敦,是将人工智能应用于靶点识别和药物重定位领域的先行者之一。其平台核心是庞大的知识图谱,整合了科学文献、生物医学数据库、多组学数据以及临床信息(图6)。通过自然语言处理和图机器学习,BenevolentAI系统能够在基因、疾病与化合物之间提出人类研究人员不易察觉的新关联。其目标是为疾病发现新的治疗靶点,或为现有药物挖掘新的适应证。这一方法的标志性成功案例是2020年baricitinib的发现。baricitinib在COVID-19患者中显示出显著的降低死亡率的疗效,并获得紧急使用授权,成为最早真正应用于患者的AI预测疗法之一(图6)。
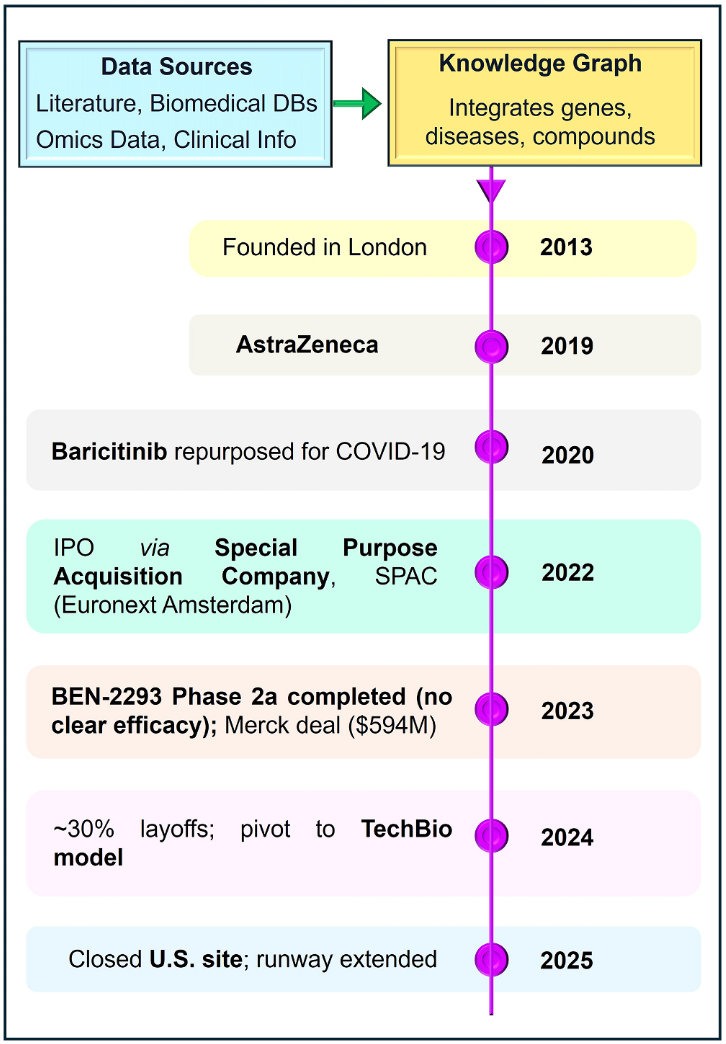
图6 BenevolentAI的知识图谱方法及里程碑
BenevolentAI同时也投入资源构建自主的新药研发管线,旨在验证其AI平台提出的新型靶点。到2022年,公司已推动至少两个新型小分子项目进入临床阶段:用于特应性皮炎(湿疹)的局部外用广谱Trk抑制剂BEN-2293以及用于溃疡性结肠炎的口服PDE10抑制剂BEN-8744(表4)。2023年,BEN-2293成为首个在临床试验中失败的高调AI来源药物。尽管该药在安全性和耐受性方面表现良好,但在改善湿疹严重程度或瘙痒方面并无显著优势。这一结果对公司造成了重大打击。最终,BenevolentAI在多年研发后终止了BEN-2293项目,说明即便是AI识别的靶点,也必须接受人类生物学的最终检验,而并非所有靶点都能成功。
表4 BenevolentAI 2024—2025年管线
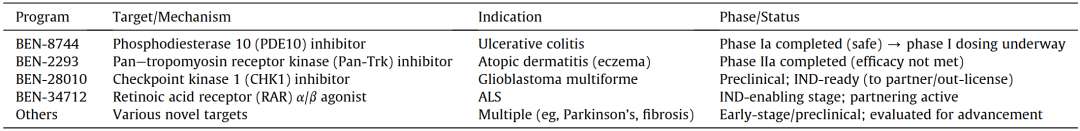
BenevolentAI的近期发展构成了一个警示性案例。即便拥有前沿AI技术和扎实科学基础,药物研发的现实依然严酷:一次重大的临床失败,便足以迫使一家中型生物技术公司进行战略转向,尤其是在缺乏其他收入来源的情况下。
薛定谔:基于物理的模拟与机器学习的融合
薛定谔总部位于纽约,成立于1990年(表5)。作为计算化学软件领域的既有领导者,薛定谔随后将业务拓展至AI驱动的药物发现领域。其核心技术是基于物理学的分子模拟平台,数十年来广泛应用于结构基础的药物设计,例如虚拟筛选以及用于预测结合亲和力的自由能计算(图7)。
表5 薛定谔时间线里程碑
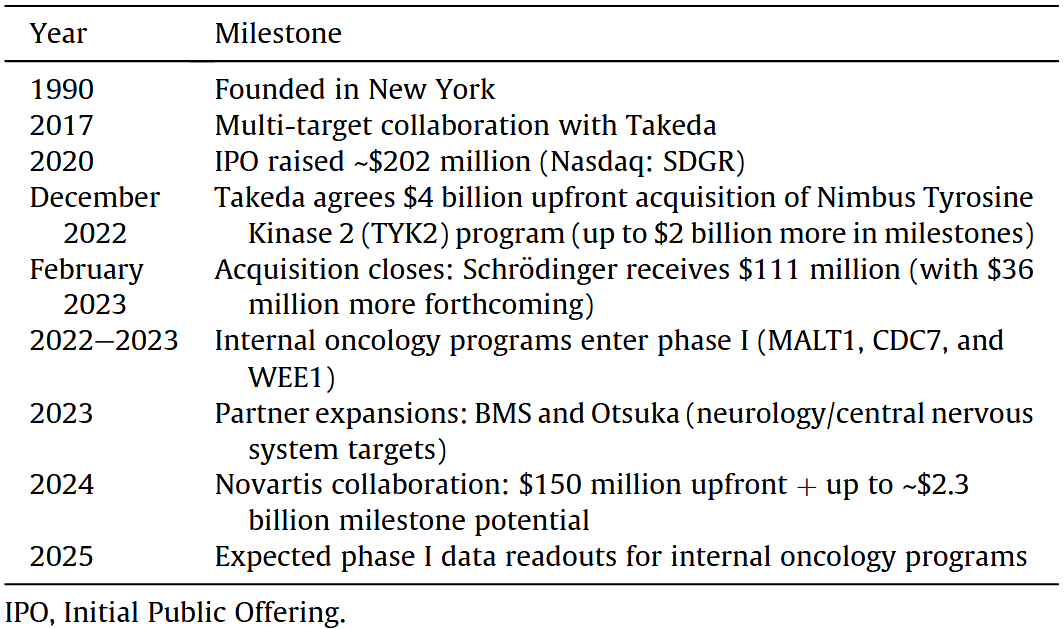
到2020年代中期,薛定谔已通过合作参与了多个临床候选药物的发现。其中最引人注目的成功案例之一,是与Nimbus Therapeutics合作发现的TYK2抑制剂NDI-034858(图7)。该药物基于薛定谔平台设计,在银屑病的Ⅱ期临床试验中显示出同类最佳的疗效,并于2022年以40亿美元的价格被武田制药收购。目前,该药物正处于Ⅲ期临床试验阶段,有望成为最早一批受到AI实质性影响而获批的药物之一。
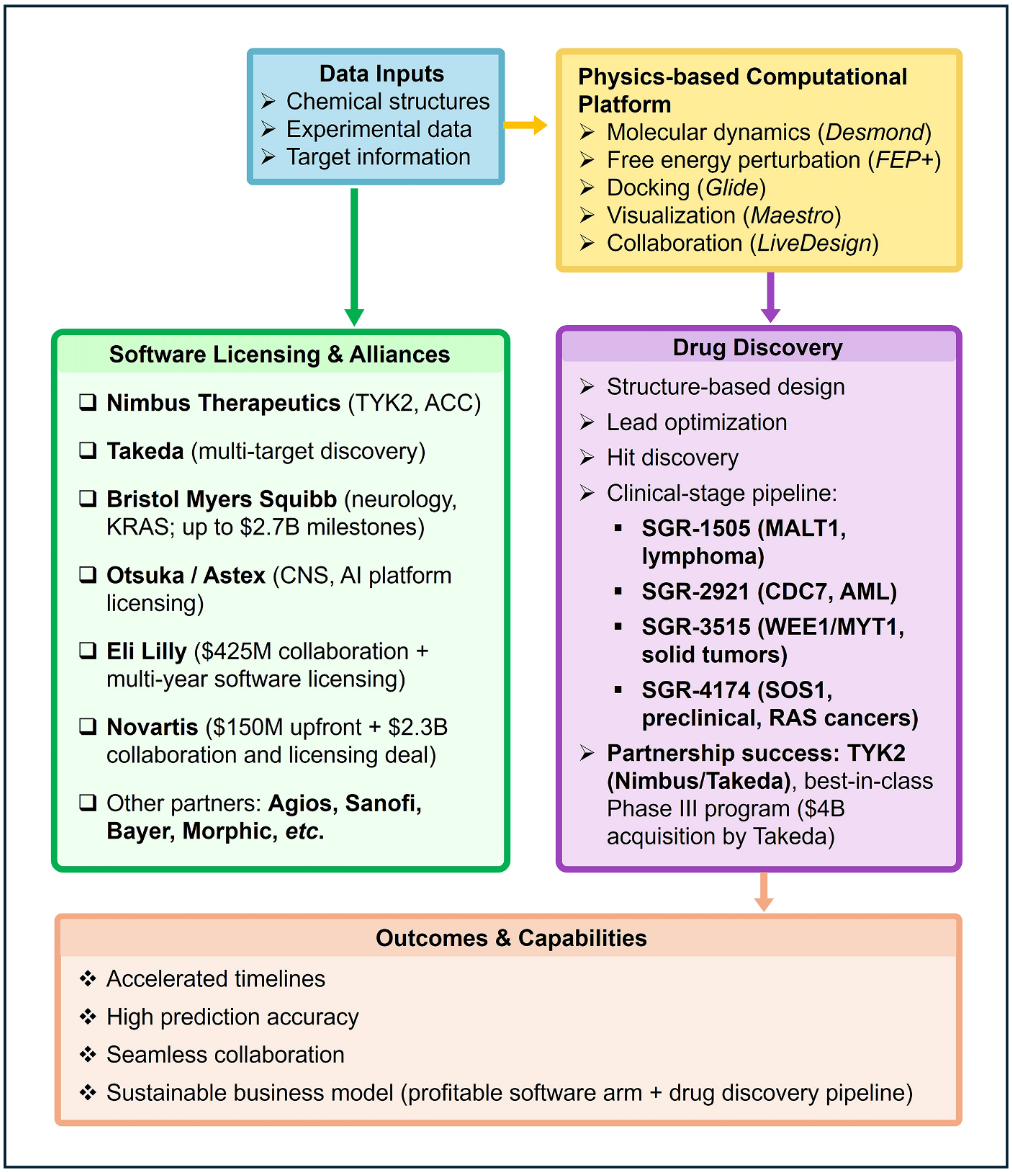
图7 薛定谔的物理驱动与AI平台
上述五家公司展示了AI在当前药物发现中应用的多样化且互补的路径。表6对它们的平台特点、迄今取得的成就以及所面临的挑战进行了比较。
表6 5家先驱AI药物发现平台比较
药理学中的机器人与人工智能:从“人工操作”到“自动驾驶式”发现
机器人技术与AI的深度融合,正将药物发现与药理学转变为一种高度高效、闭环、数据驱动的流程,并有潜力从根本上重塑科研创造力与发现模式。AI模型可以提出实验假设,而机器人平台则能够全天候持续执行实验。在这一体系中,药物DMTA工作流程形成自我强化的闭环:实验结果不断反馈至AI模型,模型据此修正预测并生成质量逐步提升的候选分子。最终目标是产出可审计的数据集、系统化报告以及适合推进临床开发的优化分子(图8)。这种“自动驾驶式”的DMTA实验室,是自动化高通量筛选与流动化学的自然演进,标志着药物发现正迈向完全自主决策的新阶段。AI与机器人融合趋势的代表性实践包括阿斯利康 iLab(哥德堡)、Recursion(盐湖城)、Insitro(南旧金山)、Emerald Cloud Lab等。
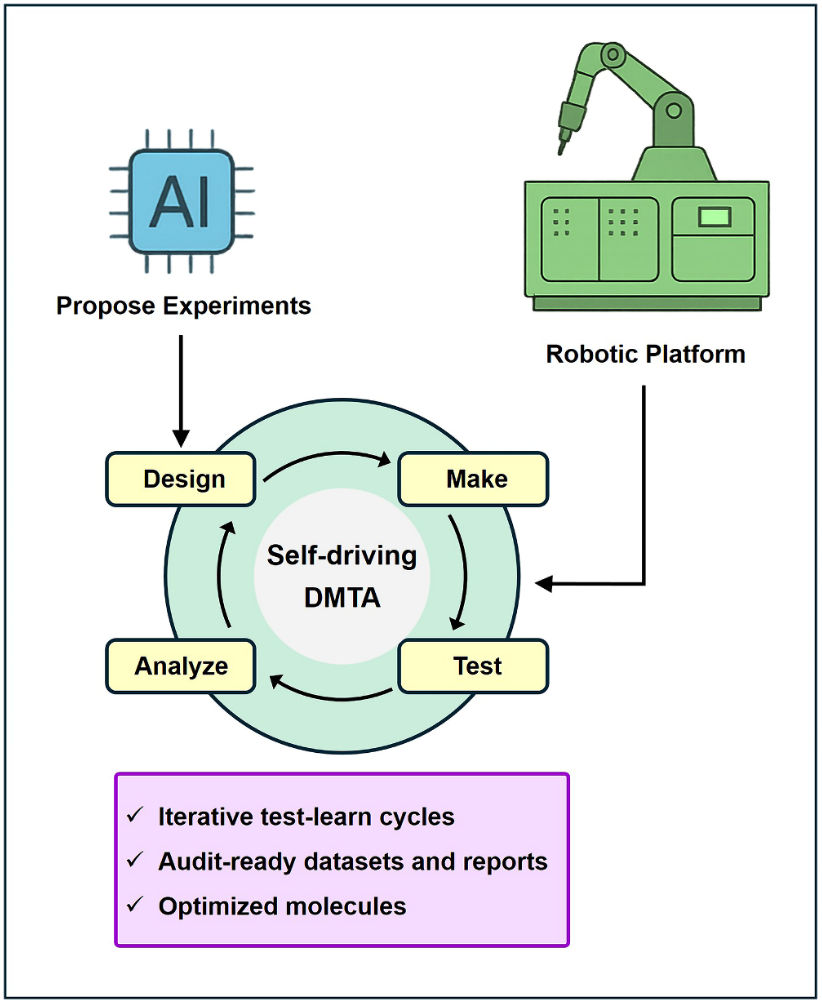
图8 AI与机器人在自驱动药物发现中的整合
AI驱动发现的下一个前沿是能够以接近人类灵巧性和情境理解能力完成复杂实验室任务的类人机器人。这些系统整合了计算机视觉、LLM推理能力以及高精度运动控制,可在最少人工监督下自主执行实验、维持细胞培养并处理试剂。特斯拉、傅利叶智能以及多家新兴中国机器人公司的早期原型,已展示出类人机器人适配实验室操作的可行性,有望将药理学研究转变为一个持续、自我校正且高通量的科研体系。类人机器人与自动驾驶实验室的融合,预示着一个协作式自动化新时代的到来。在这一时代中,AI与人类科学家共同设计并执行实验,实现更安全、更快速、更可重复的药理学创新(图9)。

图9 人形机器人在AI集成实验室中执行药理和生化实验。注:图为AI生成的概念性插图,用于展示假想的AI集成实验室技术,并不代表实际实验室系统或设备。
结论与展望
人工智能正在重塑药理学研究,通过缩短药物发现周期、潜在降低研发淘汰率,并显著拓展治疗候选分子的设计空间。在技术进步的同时,美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)也开始构建相应的监管与伦理框架,以应对透明性、偏倚、责任归属、知识产权以及数据隐私等关键问题。与AI深度融合的机器人技术正在推动“自驱动实验室”的发展,加速“设计–合成–测试–学习”循环,并提升实验的可重复性。综合来看,这些进展勾勒出一条面向未来的发展路线图:多模态基础模型、以机器人为核心的平台,以及物理模型与AI相结合的混合策略,有望加速科研成果向临床转化、降低开发风险,并使可信赖的AI成为现代药物发现的核心支柱。
参考链接:
https://doi.org/10.1016/j.pharmr.2025.100102
--------- End ---------
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2026-01-17,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读

