生化小课 | 纤维蛋白适应结构功能
生化小课 | 纤维蛋白适应结构功能

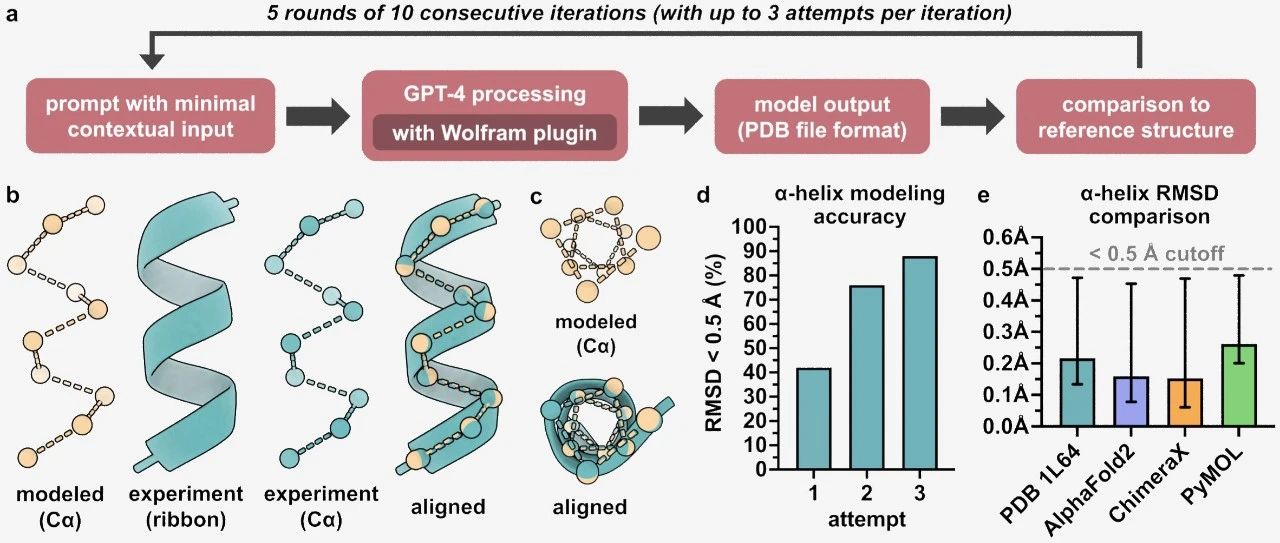
α-角蛋白、胶原蛋白和丝素蛋白很好地说明了蛋白质结构与生物功能之间的关系(表4-2)。纤维蛋白具有赋予其所在结构强度和/或灵活性的特性。在每种情况下,基本结构单元都是二级结构的简单重复元件。所有纤维蛋白均不溶于水,这一特性是由蛋白质内部及其表面的高浓度疏水性氨基酸残基赋予的。这些疏水表面大部分被掩埋,因为许多相似的多肽链堆积在一起形成复杂的超分子复合物。纤维蛋白潜在的结构简单性使其特别有助于阐明前面讨论的蛋白质结构的一些基本原理。
α-角蛋白(α-Keratin)进化是为了增强强度。这些蛋白质仅存在于哺乳动物中,几乎构成了头发、羊毛、指甲、爪子、羽毛笔、角和蹄以及大部分皮肤外层的全部干重。α-角蛋白是一个更广泛的蛋白质家族的一部分,称为中间丝 (IF) 蛋白质。其他IF蛋白存在于动物细胞的细胞骨架中。所有IF蛋白都具有结构功能,并具有α-角蛋白所示例的结构特征。
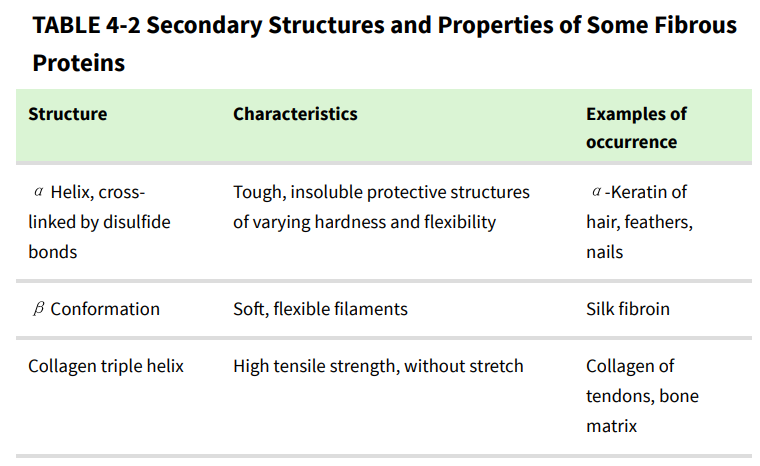
α-角蛋白螺旋是右旋α螺旋,与许多其他蛋白质中发现的螺旋相同。Francis Crick和Linus Pauling在20世纪50年代初独立提出,角蛋白的α螺旋排列成螺旋状。两条平行取向的α-角蛋白链(氨基末端在同一端)相互缠绕,形成超扭曲的螺旋。超扭曲增强了整体结构的强度,就像绞合股线形成坚固的绳索一样(图4-10)。α 螺旋轴扭转形成盘绕线圈,解释了 Pauling和Corey预测的α螺旋每圈5.4Å与头发 X射线衍射中观察到的5.15至5.2Å重复结构之间的差异。超扭曲的螺旋路径是左手的,与α螺旋的意义相反。两个α螺旋接触的表面由疏水性氨基酸残基组成,它们的R基团以规则的互锁模式啮合在一起。这允许左手超扭曲内的多肽链紧密堆积。毫不奇怪,α-角蛋白富含疏水残基Ala、Val、Leu、Ile、Met和Phe。
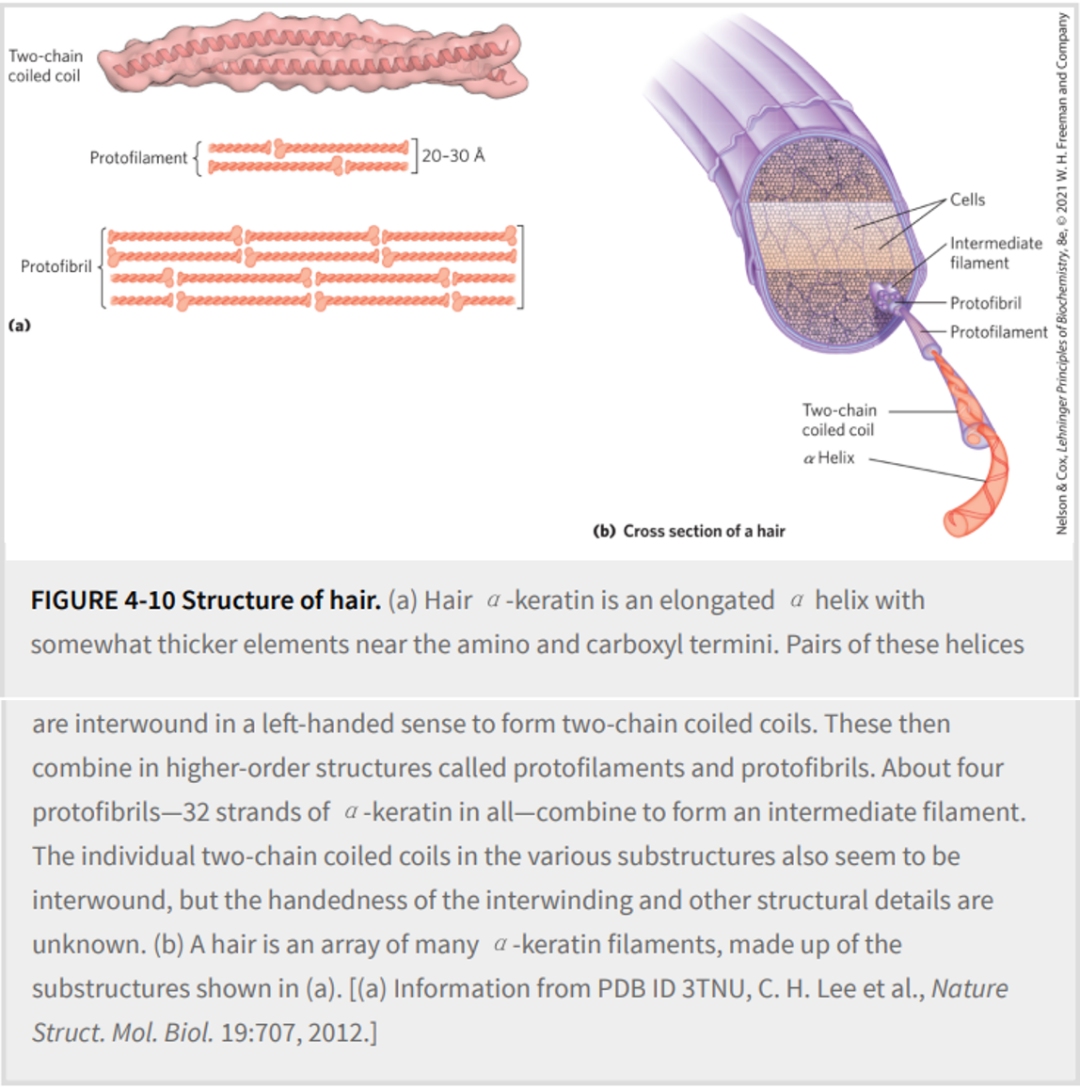
α-角蛋白卷曲螺旋中的单个多肽具有相对简单的三级结构,以α-螺旋二级结构为主,其螺旋轴扭转为左手超螺旋。两个α-螺旋多肽的缠绕是四级结构的一个例子。这种类型的卷曲线圈是丝状蛋白和肌肉蛋白肌球蛋白中常见的结构元件(见图 5-26)。α-角蛋白的四级结构可能相当复杂。许多盘绕的线圈可以组装成大型超分子复合物,例如形成头发中间丝的α-角蛋白的排列(图4-10b)。
纤维蛋白的强度通过多螺旋“绳索”中多肽链之间以及超分子组装中相邻链之间的共价交联而增强。在α-角蛋白中,稳定四级结构的交联是二硫键。在最坚硬、最坚韧的α-角蛋白中,例如犀牛角的角蛋白,高达18%的残基是参与二硫键的半胱氨酸。
胶原蛋白与α-角蛋白一样,胶原蛋白也经过进化以提供强度。它存在于结缔组织中,如肌腱、软骨、骨骼的有机基质和眼睛的角膜。事实上,胶原蛋白是哺乳动物中最丰富的蛋白质,通常占总蛋白质含量的25%至35% 胶原蛋白螺旋是一种独特的二级结构,与α螺旋截然不同。它是左旋的,每圈有3个氨基酸残基(图4-11和表4-1)。胶原蛋白也是一种卷曲的螺旋,但具有独特的三级和四级结构:三个独立的多肽,称为α链(不要与α螺旋混淆),彼此扭曲。胶原蛋白中的超螺旋扭曲是右旋的,与α链的左旋螺旋相反。
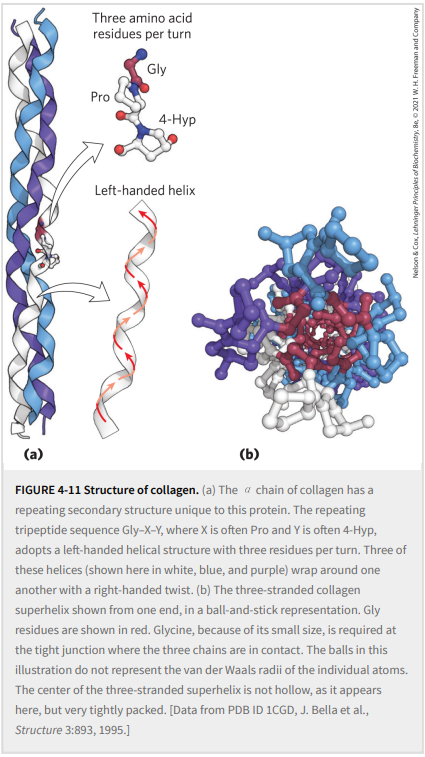
脊椎动物胶原蛋白有多种类型。通常,它们含有约35%的甘氨酸、11%的丙氨酸、21%的脯氨酸和4-Hyp(4-羟脯氨酸,一种不常见的氨基酸;见图 3-8a)。食品明胶源自胶原蛋白。作为蛋白质,它几乎没有营养价值,因为胶原蛋白在人类饮食中所必需的许多氨基酸中含量极低。胶原蛋白异常的氨基酸含量与胶原蛋白螺旋特有的结构限制有关。胶原蛋白中的氨基酸序列通常是重复的三肽单元,Gly–X–Y,其中X通常是Pro,Y通常是4-Hyp。只有甘氨酸残基才能容纳在各个α链之间非常紧密的连接处(图 4-11b)。Pro和4-Hyp残基允许胶原蛋白螺旋急剧扭曲。胶原蛋白的氨基酸序列和超扭曲四级结构使其三种多肽能够非常紧密地堆积。4-羟脯氨酸在胶原蛋白的结构以及人类历史中具有特殊的作用。
胶原蛋白三螺旋中α链的紧密包裹提供了比同等横截面的钢丝更大的拉伸强度。胶原原纤维(图4-12)是由三螺旋胶原分子(有时称为原胶原分子)组成的超分子组装体,这些分子以多种方式结合以提供不同程度的拉伸强度。胶原蛋白分子的α链和原纤维的胶原蛋白分子通过不寻常类型的共价键交联,这些共价键涉及存在于一些X和Y位置的Lys、HyLys(5-羟基赖氨酸)或His残基。这些连接产生不常见的氨基酸残基,例如脱氢羟基赖氨酸-氨基亮氨酸。老化结缔组织日益僵硬和脆弱的特性是由于胶原原纤维中积累的共价交联造成的。
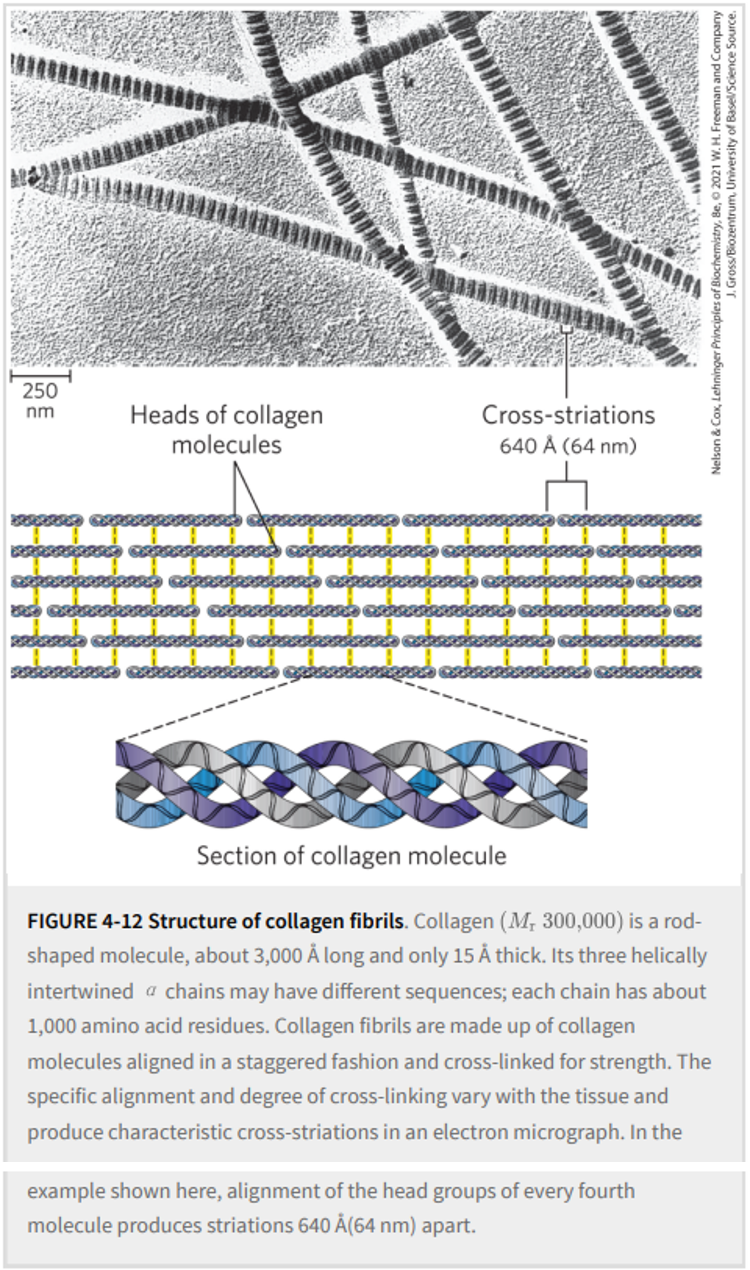
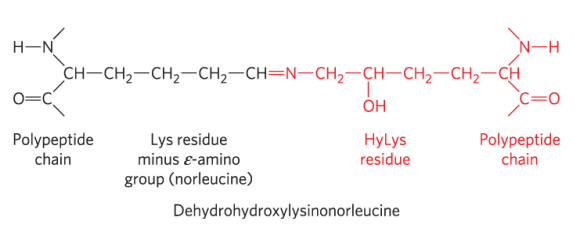
典型的哺乳动物有超过30种胶原蛋白结构变体,特别是针对某些组织,每种结构在序列和功能上都有些不同。胶原蛋白结构中的一些人类遗传缺陷说明了该蛋白质中氨基酸序列和三维结构之间的密切关系。成骨不全症的特点是婴儿骨形成异常;这种情况至少有八种不同严重程度的变种发生在人群中。埃勒斯-当洛斯综合征的特点是关节松动,人类中至少存在六种变异。作曲家尼科洛·帕格尼尼(Niccolò Paganini,1782-1840 年)以其看似不可能的小提琴演奏技巧而闻名。他患有埃勒斯-当洛斯综合症的一种变体,这使得他实际上是双关节的。在这两种疾病中,一些变异可能是致命的,而另一些变异则会导致终身问题。
丝素蛋白(Fibroin)是由昆虫和蜘蛛产生的。其多肽链主要呈β构象。丝蛋白富含Ala和Gly残基,允许紧密堆积的β折叠和联锁排列的R基团(图4-13)。通过每个β折叠的多肽中的所有肽键之间的广泛氢键以及通过折叠之间的范德华相互作用的优化来稳定整体结构。丝不拉伸,因为β构象已经高度延伸(图4-5)。然而,这种结构是灵活的,因为薄片是通过许多弱相互作用而不是像α-角蛋白中的二硫键那样通过共价键结合在一起的。

Principles of Biochemistry
本栏目信息及图片均来源于Lehninger Principles of Biochemistry 第八版,其中文字信息为英文原版的小编翻译/整理版,仅供学习交流使用,欢迎在留言区或私信听课君提供宝贵意见,如有侵权请联系删除。
部分WORKED EXAMPLE及全部Chapter Review未纳入翻译整理范围,如有需要建议参考原版图书该部分内容学习。
腾讯云开发者

扫码关注腾讯云开发者
领取腾讯云代金券
Copyright © 2013 - 2025 Tencent Cloud. All Rights Reserved. 腾讯云 版权所有
深圳市腾讯计算机系统有限公司 ICP备案/许可证号:粤B2-20090059 深公网安备号 44030502008569
腾讯云计算(北京)有限责任公司 京ICP证150476号 | 京ICP备11018762号 | 京公网安备号11010802020287
Copyright © 2013 - 2025 Tencent Cloud.
All Rights Reserved. 腾讯云 版权所有